Un alliage est un mélange de deux matériaux ou plus, dont au moins un est un métal. Les alliages peuvent avoir une microstructure consistant en des solutions solides, où des atomes secondaires sont introduits comme substituts ou interstitiels dans un réseau cristallin. Un alliage peut également être un mélange de phases métalliques (deux solutions ou plus, formant une microstructure de cristaux différents au sein du métal).
Mais tous les alliages peuvent exister dans différentes phases. Les phases sont des états physiquement homogènes d’un alliage. Une phase a une composition chimique précise – un certain arrangement et une liaison entre les atomes. Cette structure d’atomes confère des propriétés différentes aux différentes phases. Les diagrammes de phase sont des représentations graphiques des phases présentes dans un alliage à différentes conditions de température, de pression ou de composition chimique.
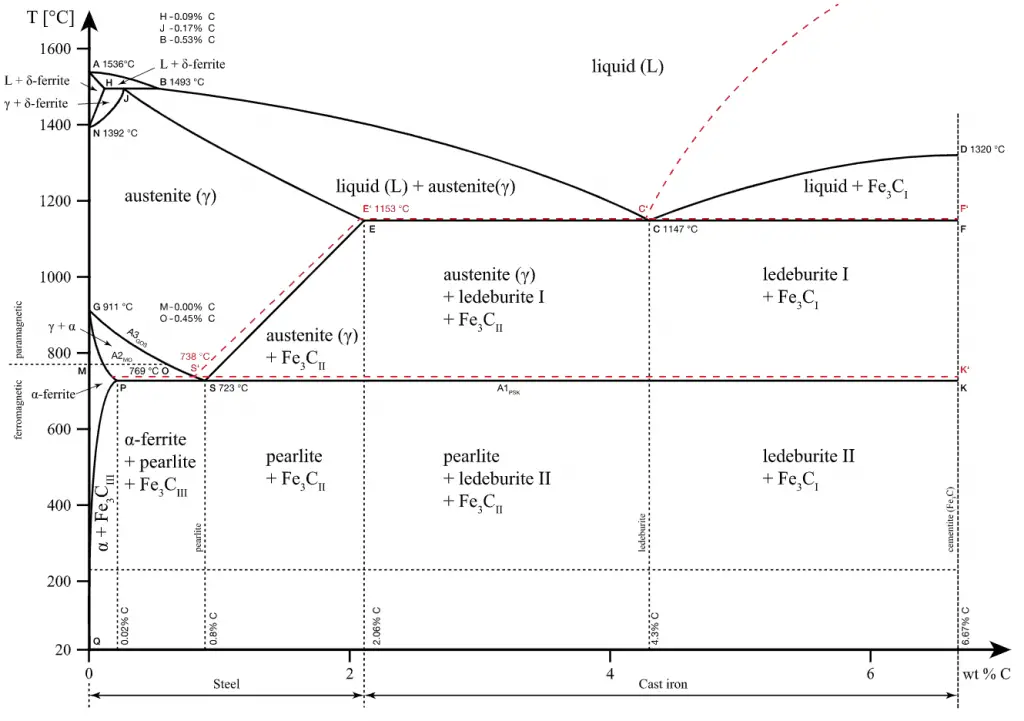
Diagramme de phase du système fer-carbone
Les alliages ferreux les plus simples sont connus sous le nom d’ aciers et ils sont constitués de fer (Fe) allié au carbone (C) (environ 0,1% à 1%, selon le type). L’ajout d’une petite quantité de carbone non métallique au fer échange sa grande ductilité contre une plus grande résistance. En raison de sa résistance très élevée, mais toujours substantielle , et de sa capacité à être fortement altérée par le traitement thermique, l’acier est l’un des alliages ferreux les plus utiles et les plus courants dans l’utilisation moderne. Sur la figure, il y a le carbure de fer-fer (Fe-Fe3C) diagramme de phase. Le pourcentage de carbone présent et la température définissent la phase de l’alliage fer-carbone et donc ses caractéristiques physiques et ses propriétés mécaniques. Le pourcentage de carbone détermine le type d’alliage ferreux: fer, acier ou fonte.
Phases courantes dans les aciers et les fers
Le traitement thermique des aciers nécessite une compréhension à la fois des phases d’équilibre et des phases métastables qui se produisent lors du chauffage et/ou du refroidissement. Pour les aciers, les phases d’équilibre stable comprennent:
- Ferrite. La ferrite ou α-ferrite est une phase de structure cubique centrée du fer qui existe en dessous de températures de 912 °C pour de faibles concentrations de carbone dans le fer. L’α-ferrite ne peut dissoudre que jusqu’à 0,02 % de carbone à 727 °C. Cela est dû à la configuration du réseau de fer qui forme une structure cristalline BCC. La phase primaire de l’acier à faible teneur en carbone ou doux et de la plupart des fontes à température ambiante est ferromagnétique α-Fe.
- Austénite. L’austénite, également connue sous le nom de fer en phase gamma (γ-Fe), est une phase de fer à structure cubique à faces centrées non magnétique. L’austénite dans les alliages fer-carbone n’est généralement présente qu’au-dessus de la température eutectoïde critique (723 °C) et en dessous de 1500 °C, selon la teneur en carbone. Cependant, il peut être conservé à température ambiante par des ajouts d’alliages tels que le nickel ou le manganèse. Le carbone joue un rôle important dans le traitement thermique, car il élargit la plage de température de stabilité de l’austénite. Une teneur en carbone plus élevée abaisse la température nécessaire pour austénitiser l’acier, de sorte que les atomes de fer se réarrangent pour former une structure de réseau fcc. L’austénite est présente dans le type d’acier inoxydable le plus couramment utilisé, qui est très connu pour sa résistance à la corrosion.
- Graphite. L’ajout d’une petite quantité de carbone non métallique au fer échange sa grande ductilité contre une plus grande résistance.
- Cémentite. La cémentite (Fe3C) est un composé métastable et, dans certaines circonstances, on peut la dissocier ou la décomposer pour former de l’α-ferrite et du graphite, selon la réaction: Fe3C → 3Fe (α) + C (graphite). La cémentite dans sa forme pure est une céramique et elle est dure et cassante, ce qui la rend appropriée pour le renforcement des aciers. Ses propriétés mécaniques sont fonction de sa microstructure, qui dépend de la manière dont il est mélangé à la ferrite.
Les phases métastables sont:
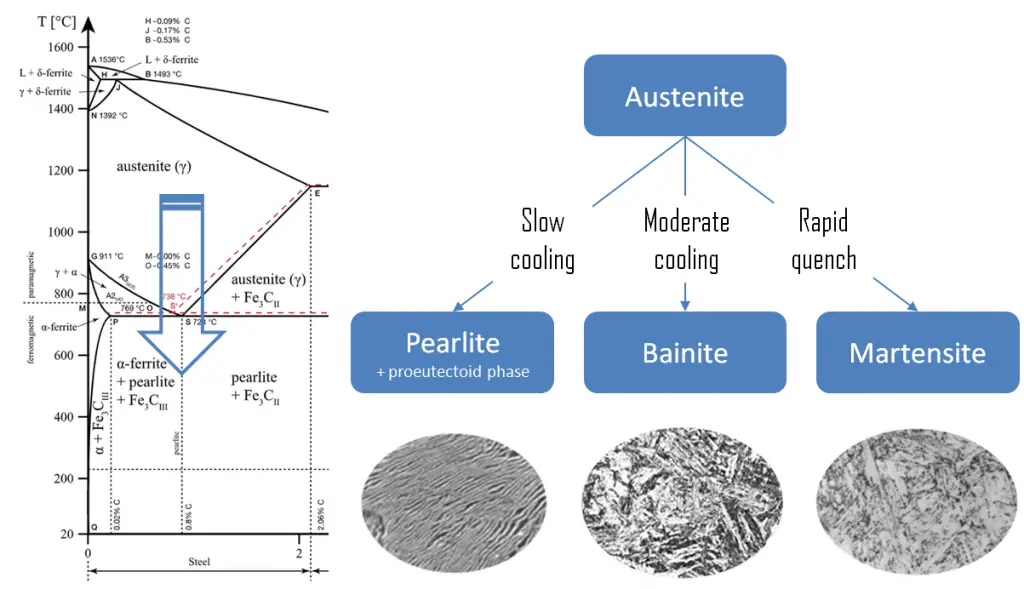 Perlite. En métallurgie, la perlite est une structure métallique en couches de deux phases, qui se compose de couches alternées de ferrite (87,5 % en poids) et de cémentite (12,5 % en poids) que l’on trouve dans certains aciers et fontes. Il est nommé pour sa ressemblance avec la nacre.
Perlite. En métallurgie, la perlite est une structure métallique en couches de deux phases, qui se compose de couches alternées de ferrite (87,5 % en poids) et de cémentite (12,5 % en poids) que l’on trouve dans certains aciers et fontes. Il est nommé pour sa ressemblance avec la nacre.- Martensite. La martensite est une structure métastable très dure avec une structure cristalline tétragonale centrée sur le corps (BCT). La martensite se forme dans les aciers lorsque la vitesse de refroidissement de l’austénite est si élevée que les atomes de carbone n’ont pas le temps de se diffuser hors de la structure cristalline en quantité suffisante pour former de la cémentite (Fe3C).
- Baïnite. La bainite est une microstructure en forme de plaque qui se forme dans les aciers à partir d’austénite lorsque les vitesses de refroidissement ne sont pas
assez rapides pour produire de la martensite mais sont encore assez rapides pour que le carbone n’ait pas assez de temps pour se diffuser pour former de la perlite. Les aciers bainitiques sont généralement plus résistants et plus durs que les aciers perlitiques; pourtant, ils présentent une combinaison souhaitable de résistance et de ductilité.
Température critique de l’acier
La température critique de l’acier définit la transition de phase entre deux phases de l’acier. Lorsque l’ acier est chauffé au-dessus de la température critique, environ 1335 °F (724 °C), il subit un changement de phase, se recristallisant en austénite. Il existe deux types de température critique:
- Température critique inférieure (Ac1). La température à laquelle l’austénite commence à se transformer à partir de la ferrite.
- Température critique supérieure (Ac3). La température à laquelle l’austénite est complètement transformée à partir de la ferrite.
Dans le système Fe-C, il y a un point eutectoïde à environ 0,8% en poids C, 723 °C. La phase juste au-dessus de la température eutectoïde pour les aciers au carbone simples est connue sous le nom d’austénite ou gamma.
Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 and 2. Janvier 1993.
US Department of Energy, Material Science. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
González-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1.
Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Diagrammes de phase du système fer-carbone, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.