Las propiedades térmicas de los materiales se refieren a la respuesta de los materiales a los cambios de thermodynamics/thermodynamic-properties/what-is-temperature-physics/»>temperatura y a la aplicación de calor. A medida que un sólido absorbe thermodynamics/what-is-energy-physics/»>energía en forma de calor, su temperatura aumenta y sus dimensiones aumentan. Pero los diferentes materiales reaccionan a la aplicación de calor de manera diferente.
La capacidad calorífica, la expansión térmica y la conductividad térmica son propiedades que a menudo son críticas en el uso práctico de sólidos.
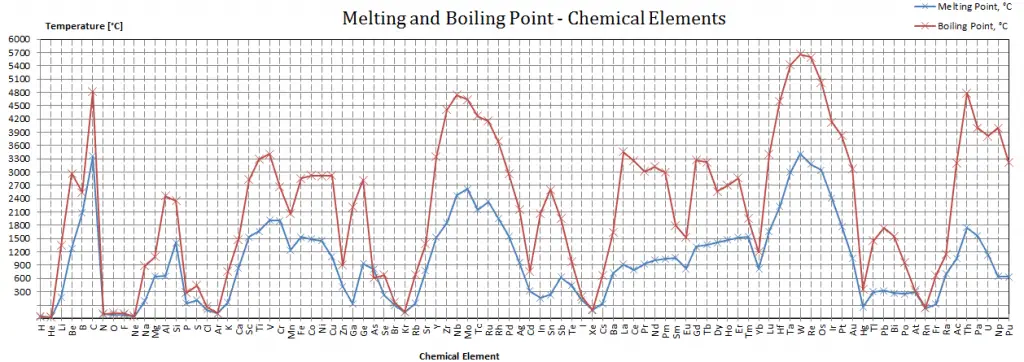
Punto de fusión de materiales
Tenga en cuenta que estos puntos están asociados con la presión atmosférica estándar.
Ver también: Puntos de fusión – Tabla periódica
En general, la fusión es un cambio de fase de una sustancia de la fase sólida a la líquida. El punto de fusión de una sustancia es la temperatura a la que se produce este cambio de fase. El punto de fusión también define una condición en la que el sólido y el líquido pueden existir en equilibrio. Agregar calor convertirá el sólido en líquido sin cambios de temperatura. En el punto de fusión, las dos fases de una sustancia, líquido y vapor, tienen energías libres idénticas y, por lo tanto, es igualmente probable que existan. Por debajo del punto de fusión, el sólido es el estado más estable de los dos, mientras que por encima se prefiere la forma líquida. El punto de fusión de una sustancia depende de la presión y generalmente se especifica a presión estándar. Cuando se considera como la temperatura del cambio inverso de líquido a sólido, se denomina punto de congelación o punto de cristalización.
Ver también: depresión del punto de fusión
La primera teoría que explica el mecanismo de fusión a granel fue propuesta por Lindemann, quien utilizó la vibración de los átomos en el cristal para explicar la transición de fusión. Los sólidos son similares a los líquidos en que ambos son estados condensados, con partículas que están mucho más juntas que las de un gas. Los átomos de un sólido están estrechamente unidos entre sí, ya sea en una red geométrica regular (sólidos cristalinos, que incluyen metales y hielo ordinario) o irregularmente (un sólido amorfo como el vidrio de ventana común), y por lo general tienen poca energía. El movimiento de átomos, iones o moléculas individuales en un sólido está restringido al movimiento vibratorio alrededor de un punto fijo. A medida que se calienta un sólido, sus partículas vibran más rápidamente a medida que el sólido absorbe energía cinética. En algún momento, la amplitud de la vibración se vuelve tan grande que los átomos comienzan a invadir el espacio de sus vecinos más cercanos y los perturban y se inicia el proceso de fusión. El punto de fusión es la temperatura a la que las vibraciones disruptivas de las partículas del sólido superan las fuerzas de atracción que operan dentro del sólido.
Al igual que con los puntos de ebullición, el punto de fusión de un sólido depende de la fuerza de esas fuerzas atractivas. Por ejemplo, el cloruro de sodio (NaCl) es un compuesto iónico que consta de una multitud de enlaces iónicos fuertes. El cloruro de sodio se funde a 801°C. Por otro lado, el hielo (H2O sólido ) es un compuesto molecular cuyas moléculas se mantienen unidas por enlaces de hidrógeno, lo que constituye un claro ejemplo de interacción entre dos dipolos permanentes. Aunque los enlaces de hidrógeno son las fuerzas intermoleculares más fuertes, la fuerza de los enlaces de hidrógeno es mucho menor que la de los enlaces iónicos. El punto de fusión del hielo es de 0°C.
Los enlaces covalentes a menudo dan como resultado la formación de pequeñas colecciones de átomos mejor conectados llamados moléculas, que en sólidos y líquidos están unidos a otras moléculas por fuerzas que a menudo son mucho más débiles que los enlaces covalentes que mantienen unidas las moléculas internamente. Estos enlaces intermoleculares débiles dan a las sustancias moleculares orgánicas, como ceras y aceites, su carácter de masa blanda y sus puntos de fusión bajos (en los líquidos, las moléculas deben dejar de tener un contacto más estructurado u orientado entre sí).
Esperamos que este artículo, Punto de fusión de materiales , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.