En general, los sólidos se caracterizan por su rigidez estructural y resistencia a cambios de forma o volumen. A diferencia de un líquido, un objeto sólido no fluye para tomar la forma de su recipiente, ni se expande para llenar todo el volumen disponible como lo hace un gas. Los sólidos tienen mayores atracciones interatómicas que los líquidos y los gases. Sin embargo, existen amplias variaciones en las propiedades de los materiales sólidos utilizados con fines de ingeniería. Las propiedades de los materiales dependen de sus enlaces interatómicos . Estos mismos enlaces también dictan el espacio entre la configuración de los átomos en los sólidos.
Sólidos cristalinos

Los átomos de un sólido cristalino están estrechamente unidos entre sí, ya sea en una red geométrica regular (sólidos cristalinos, que incluyen metales y hielo ordinario). Un material cristalino es aquel en el que los átomos están situados en una matriz periódica o repetida sobre grandes distancias atómicas, es decir, existe un orden de largo alcance, de modo que al solidificarse, los átomos se posicionarán en un patrón tridimensional repetitivo, en que cada átomo está unido a sus átomos vecinos más cercanos. No todos los sólidos son monocristales. Por ejemplo, cuando el agua líquida comienza a congelarse, el cambio de fase comienza con pequeños cristales de hielo que crecen hasta fusionarse, formando una estructura policristalina. En el bloque final de hielo, cada uno de los pequeños cristales (llamados » granos«) es un verdadero cristal con una disposición periódica de átomos, pero todo el policristal no tiene una disposición periódica de átomos, porque el patrón periódico se rompe en los límites de los granos .
Red cristalina
Algunas de las propiedades de los sólidos cristalinos dependen de la estructura cristalina del material, la forma en que los átomos, iones o moléculas están dispuestos espacialmente. Una red de cristal es un patrón repetitivo de puntos matemáticos que se extiende por todo el espacio. Las fuerzas de los enlaces químicos provocan esta repetición. Es este patrón repetido el que controla propiedades como resistencia , ductilidad , densidad , conductividad (propiedad de conducir o transmitir calor, electricidad, etc.) y forma . Hay 14 tipos generales de patrones conocidos como celosías de Bravais .
Se encuentran tres estructuras cristalinas relativamente simples para la mayoría de los metales comunes:
-
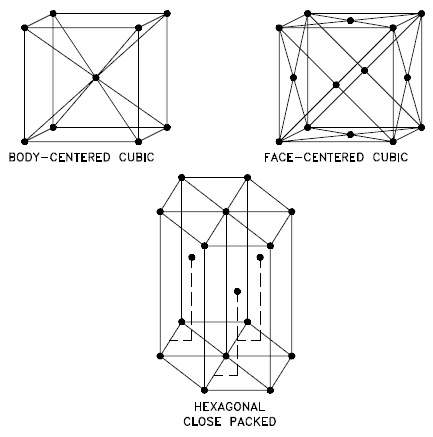
Fuente: Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993. Cúbico centrado en el cuerpo – bcc. En una disposición de átomos bcc (BCC), la celda unitaria consta de ocho átomos en las esquinas de un cubo y un átomo en el centro del cuerpo del cubo. En una disposición bcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (1 átomo central × 1) = 2 átomos. El empaque es más eficiente (68%) que el cúbico simple y la estructura es común para metales alcalinos y metales de transición tempranos. Los metales que contienen estructuras de BCC incluyen ferrita, cromo, vanadio, molibdeno y tungsteno. Estos metales poseen alta resistencia y baja ductilidad.
- Cúbico centrado en la cara – fcc. En una disposición de átomos fcc (FCC), la celda unitaria consta de ocho átomos en las esquinas de un cubo y un átomo en el centro de cada una de las caras del cubo. En una disposición fcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (6 átomos de cara × ½) = 4 átomos. Esta estructura, junto con su pariente hexagonal (hcp), tiene el empaque más eficiente (74%). Los metales que contienen estructuras de FCC incluyen austenita, aluminio, cobre, plomo, plata, oro, níquel, platino y torio. Estos metales poseen baja resistencia y alta ductilidad.
- Hexagonal compacto – hcp. En una disposición de átomos hcp (HCP), la celda unitaria consta de tres capas de átomos. Las capas superior e inferior contienen seis átomos en las esquinas de un hexágono y un átomo en el centro de cada hexágono. La capa intermedia contiene tres átomos ubicados entre los átomos de las capas superior e inferior, de ahí el nombre de empaquetado compacto. El empaquetamiento cerrado hexagonal (hcp) es uno de los dos tipos simples de empaquetamiento atómico con la densidad más alta, siendo el otro el cúbico centrado en la cara (fcc). Sin embargo, a diferencia de la fcc, no es una celosía de Bravais, ya que hay dos conjuntos de puntos de celosía no equivalentes. Los metales que contienen estructuras de HCP incluyen berilio, magnesio, zinc, cadmio, cobalto, talio y circonio. Los metales HCP no son tan dúctiles como los metales FCC.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
Esperamos que este artículo, Sólidos cristalinos – Materiales cristalinos , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.