En général, les solides se caractérisent par une rigidité structurelle et une résistance aux changements de forme ou de volume. Contrairement à un liquide, un objet solide ne s’écoule pas pour prendre la forme de son récipient, ni ne se dilate pour remplir tout le volume dont il dispose comme le fait un gaz. Les solides ont de plus grandes attractions interatomiques que les liquides et les gaz. Cependant, il existe de grandes variations dans les propriétés des matériaux solides utilisés à des fins d’ingénierie. Les propriétés des matériaux dépendent de leurs liaisons interatomiques. Ces mêmes liaisons dictent également l’espace entre la configuration des atomes dans les solides.
Solides cristallins

Les atomes d’un solide cristallin sont étroitement liés les uns aux autres, soit dans un réseau géométrique régulier (solides cristallins, qui comprennent les métaux et la glace ordinaire). Un matériau cristallin est un matériau dans lequel les atomes sont situés dans un réseau répétitif ou périodique sur de grandes distances atomiques, c’est-à-dire qu’il existe un ordre à longue portée, tel que lors de la solidification, les atomes se positionneront dans un motif tridimensionnel répétitif, en où chaque atome est lié à ses atomes voisins les plus proches. Tous les solides ne sont pas des monocristaux. Par exemple, lorsque l’eau liquide commence à geler, le changement de phase commence par de petits cristaux de glace qui se développent jusqu’à fusionner, formant une structure polycristalline. Dans le dernier bloc de glace, chacun des petits cristaux (appelés « grains« ) est un vrai cristal avec un arrangement périodique d’atomes, mais l’ensemble du polycristal n’a pas d’arrangement périodique d’atomes, car le motif périodique est rompu aux joints de grains.
Treillis de cristal
Certaines des propriétés des solides cristallins dépendent de la structure cristalline du matériau, de la manière dont les atomes, les ions ou les molécules sont disposés dans l’espace. Un réseau cristallin est un motif répétitif de points mathématiques qui s’étend dans tout l’espace. Les forces de la liaison chimique provoquent cette répétition. C’est ce motif répété qui contrôle les propriétés telles que la résistance, la ductilité, la densité, la conductivité (propriété de conduire ou de transmettre la chaleur, l’électricité, etc.) et la forme. Il existe 14 types généraux de tels motifs connus sous le nom de réseaux de Bravais.
Trois structures cristallines relativement simples se retrouvent pour la plupart des métaux courants:
-
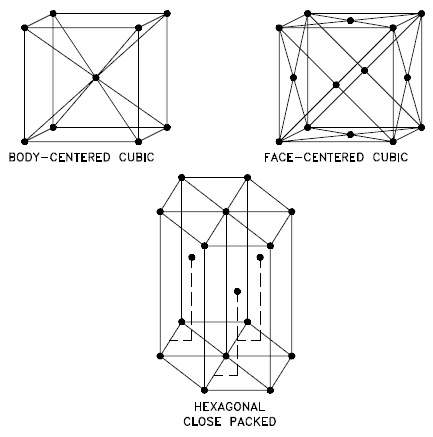
Source: Département américain de l’énergie, Science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993. Cubique centré sur le corps – bcc. Dans un arrangement d’atomes bcc (BCC), la cellule unitaire se compose de huit atomes aux coins d’un cube et d’un atome au centre du corps du cube. Dans un arrangement bcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (1 atome central × 1) = 2 atomes. Le garnissage est plus efficace (68%) que le simple cubique et la structure est courante pour les métaux alcalins et les métaux de transition précoce. Les métaux contenant des structures BCC comprennent la ferrite, le chrome, le vanadium, le molybdène et le tungstène. Ces métaux possèdent une résistance élevée et une faible ductilité.
- Cubique à faces centrées – fcc. Dans un arrangement d’atomes fcc (FCC), la cellule unitaire se compose de huit atomes aux coins d’un cube et d’un atome au centre de chacune des faces du cube. Dans un arrangement fcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (6 atomes de face × ½) = 4 atomes. Cette structure, avec son parent hexagonal (hcp), a le garnissage le plus efficace (74%). Les métaux contenant des structures FCC comprennent l’austénite, l’aluminium, le cuivre, le plomb, l’argent, l’or, le nickel, le platine et le thorium. Ces métaux possèdent une faible résistance et une ductilité élevée.
- Hexagonal Compact – hcp. Dans un arrangement d’atomes hcp (HCP), la cellule unitaire est constituée de trois couches d’atomes. Les couches supérieure et inférieure contiennent six atomes aux coins d’un hexagone et un atome au centre de chaque hexagone. La couche intermédiaire contient trois atomes nichés entre les atomes des couches supérieure et inférieure, d’où le nom de compact. Hexagonal Close Packed (hcp) est l’un des deux types simples de garnissage atomique avec la densité la plus élevée, l’autre étant le cubique à faces centrées (fcc). Cependant, contrairement au fcc, ce n’est pas un réseau de Bravais car il existe deux ensembles non équivalents de points de réseau. Les métaux contenant des structures HCP comprennent le béryllium, le magnésium, le zinc, le cadmium, le cobalt, le thallium et le zirconium. Les métaux HCP ne sont pas aussi ductiles que les métaux FCC.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Solides cristallins – Matériaux cristallins, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.