Un élément chimique est une espèce d’atome ayant le même nombre de protons dans leurs noyaux atomiques (c’est-à-dire le même numéro atomique, ou Z). Par exemple, le numéro atomique du carbone est 6, donc l’élément carbone se compose de tous les atomes qui ont exactement 6 protons.
Un élément chimique est une espèce d’atome ayant le même nombre de protons dans leurs noyaux atomiques (c’est-à-dire le même numéro atomique, ou Z). Par exemple, le numéro atomique du carbone est 6, donc l’élément carbone se compose de tous les atomes qui ont exactement 6 protons.
Les propriétés chimiques de l’atome sont déterminées par le nombre de protons, en fait, par le nombre et la disposition des électrons. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
Tableau périodique
Le tableau périodique est une disposition tabulaire des éléments chimiques. Il est organisé par ordre de numéro atomique croissant. Il existe un modèle récurrent appelé «loi périodique» dans leurs propriétés, dans lequel les éléments d’une même colonne (groupe) ont des propriétés similaires. Généralement, dans une ligne (période), les éléments sont des métaux à gauche et des non-métaux à droite, les éléments ayant des comportements chimiques similaires étant placés dans la même colonne.
Propriétés chimiques des éléments
Chaque solide, liquide, gaz et plasma est composé d’atomes neutres ou ionisés. Les propriétés chimiques de l’atome sont déterminées par le nombre de protons, en fait, par le nombre et la disposition des électrons. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
Le nombre total de protons dans le noyau d’un atome est appelé le numéro atomique (ou le nombre de protons) de l’atome et reçoit le symbole Z. Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. La charge électrique totale du noyau est donc +Ze , où e (charge élémentaire) vaut 1 602 x 10-19 coulombs. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
C’est le principe d’exclusion de Pauli qui exige que les électrons d’un atome occupent différents niveaux d’énergie au lieu qu’ils se condensent tous dans l’état fondamental. L’ordre des électrons dans l’état fondamental des atomes multiélectrons commence par l’état d’énergie le plus bas (état fondamental) et se déplace progressivement de là vers le haut de l’échelle d’énergie jusqu’à ce que chacun des électrons de l’atome se soit vu attribuer un ensemble unique de nombres quantiques. Ce fait a des implications essentielles pour la construction du tableau périodique des éléments.
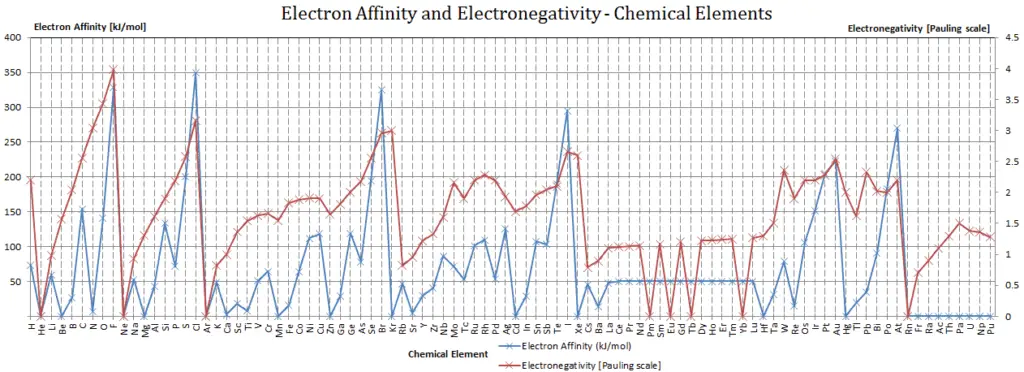
Affinité électronique
En chimie et en physique atomique, l’ affinité électronique d’un atome ou d’une molécule est définie comme:
la variation d’énergie (en kJ/mole) d’un atome ou d’une molécule neutre (en phase gazeuse) lorsqu’un électron est ajouté à l’atome pour former un ion négatif.
X + e– → X– + énergie Affinité = – ∆H
En d’autres termes, il peut être exprimé comme la probabilité qu’a l’atome neutre de gagner un électron. Notez que les énergies d’ionisation mesurent la tendance d’un atome neutre à résister à la perte d’électrons. Les affinités électroniques sont plus difficiles à mesurer que les énergies d’ionisation.
Un atome de fluor en phase gazeuse, par exemple, dégage de l’énergie lorsqu’il gagne un électron pour former un ion fluorure.
F + e– → F– – ∆H = Affinité = 328 kJ/mol
Pour utiliser correctement les affinités électroniques, il est essentiel de garder une trace du signe. Lorsqu’un électron est ajouté à un atome neutre, de l’énergie est libérée. Cette affinité est connue sous le nom de première affinité électronique et ces énergies sont négatives. Par convention, le signe négatif indique un dégagement d’énergie. Cependant, plus d’énergie est nécessaire pour ajouter un électron à un ion négatif qui submerge toute la libération d’énergie du processus de fixation des électrons. Cette affinité est connue sous le nom de deuxième affinité électronique et ces énergies sont positives.
Affinités des non-métaux vs. Affinités des métaux
- Métaux: Les métaux aiment perdre des électrons de valence pour former des cations afin d’avoir une coquille totalement stable. L’affinité électronique des métaux est inférieure à celle des non-métaux. Mercure attire le plus faiblement un électron supplémentaire.
- Non- métaux: Généralement, les non-métaux ont une affinité électronique plus positive que les métaux. Les non-métaux aiment gagner des électrons pour former des anions afin d’avoir une couche d’électrons entièrement stable. Le chlore attire le plus fortement les électrons supplémentaires. Les affinités électroniques des gaz nobles n’ont pas été mesurées de manière concluante, elles peuvent donc ou non avoir des valeurs légèrement négatives.
Électronégativité
L’électronégativité, symbole χ, est une propriété chimique qui décrit la tendance d’un atome à attirer des électrons vers cet atome. A cet effet, une quantité sans dimension l’ échelle de Pauling, symbole χ, est la plus couramment utilisée.
L’électronégativité du fluor est:
χ = 4,0
En général, l’électronégativité d’un atome est affectée à la fois par son numéro atomique et par la distance à laquelle ses électrons de valence résident du noyau chargé. Plus le nombre d’électronégativité associé est élevé, plus un élément ou un composé attire les électrons vers lui.
L’atome le plus électronégatif, le fluor, se voit attribuer une valeur de 4,0, et les valeurs vont jusqu’au césium et au francium qui sont les moins électronégatifs à 0,7.
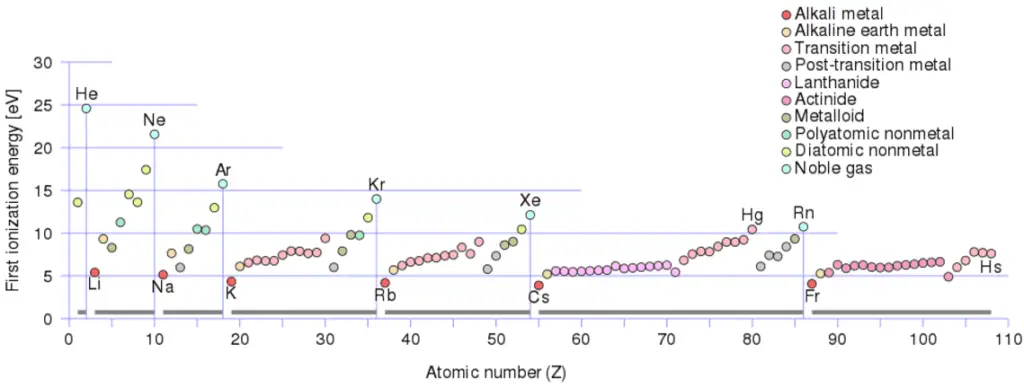
Énergie d’ionisation
L’énergie d’ionisation, également appelée potentiel d’ionisation, est l’énergie nécessaire pour retirer un électron de l’atome neutre.
X + énergie → X+ + e−
où X est n’importe quel atome ou molécule capable d’être ionisé, X+ est cet atome ou molécule avec un électron retiré (ion positif), et e – est l’électron retiré.
Un atome d’azote, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus externe.
N + IE → N+ + e– IE = 14,5 eV
L’énergie d’ionisation associée à l’élimination du premier électron est la plus couramment utilisée. La n ième énergie d’ionisation fait référence à la quantité d’énergie nécessaire pour éliminer un électron de l’espèce avec une charge de ( n -1).
1ère énergie d’ionisation
X → X+ + e−
2ème énergie d’ionisation
X+ → X2+ + e−
3ème énergie d’ionisation
X2+ → X3+ + e−
Énergie d’ionisation pour différents éléments
Il existe une énergie d’ionisation pour chaque électron successif éliminé. Les électrons qui entourent le noyau se déplacent sur des orbites assez bien définies. Certains de ces électrons sont plus étroitement liés dans l’atome que d’autres. Par exemple, seulement 7,38 eV sont nécessaires pour éliminer l’électron le plus externe d’un atome de plomb, tandis que 88 000 eV sont nécessaires pour éliminer l’électron le plus interne. Aide à comprendre la réactivité des éléments (en particulier les métaux, qui perdent des électrons).
En général, l’énergie d’ionisation augmente en remontant d’un groupe et en se déplaçant de gauche à droite sur une période. En outre:
- L’énergie d’ionisation est la plus faible pour les métaux alcalins qui ont un seul électron à l’extérieur d’une coquille fermée.
- L’énergie d’ionisation augmente sur une ligne sur le maximum périodique pour les gaz nobles qui ont des coquilles fermées
Par exemple, le sodium ne nécessite que 496 kJ/mol ou 5,14 eV/atome pour l’ioniser. Par contre le néon, le gaz rare qui le précède immédiatement dans le tableau périodique, nécessite 2081 kJ/mol ou 21,56 eV/atome.
Nous espérons que cet article, Éléments chimiques, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L'objectif principal de ce site Web est d'aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.