Un elemento químico es una especie de átomo que tiene el mismo número de protones en sus núcleos atómicos (es decir, el mismo número atómico, o Z). Por ejemplo, el número atómico del carbono es 6, por lo que el elemento carbono consta de todos los átomos que tienen exactamente 6 protones.
Un elemento químico es una especie de átomo que tiene el mismo número de protones en sus núcleos atómicos (es decir, el mismo número atómico, o Z). Por ejemplo, el número atómico del carbono es 6, por lo que el elemento carbono consta de todos los átomos que tienen exactamente 6 protones.
Las propiedades químicas del átomo están determinadas por el número de protones, de hecho, por el número y disposición de los electrones. La configuración de estos electrones se deriva de los principios de la mecánica cuántica. El número de electrones en las capas de electrones de cada elemento, particularmente la capa de valencia más externa, es el factor principal para determinar su comportamiento de enlace químico. En la tabla periódica, los elementos se enumeran en orden de número atómico creciente Z.
Tabla periódica
La tabla periódica es una disposición tabular de los elementos químicos. Está organizado en orden creciente de número atómico. Existe un patrón recurrente llamado "ley periódica" en sus propiedades, en el que los elementos de la misma columna (grupo) tienen propiedades similares. Generalmente, dentro de una fila (período) los elementos son metales a la izquierda y no metales a la derecha, con los elementos que tienen comportamientos químicos similares colocados en la misma columna.
Propiedades químicas de los elementos
Todo sólido, líquido, gas y plasma está compuesto por átomos neutros o ionizados. Las propiedades químicas del átomo están determinadas por el número de protones, de hecho, por el número y la disposición de los electrones. La configuración de estos electrones se deriva de los principios de la mecánica cuántica. El número de electrones en las capas de electrones de cada elemento, particularmente la capa de valencia más externa, es el factor principal para determinar su comportamiento de enlace químico. En la tabla periódica, los elementos se enumeran en orden de número atómico creciente Z.
El número total de protones en el núcleo de un átomo se llama el número atómico (o el número de protones ) del átomo y se le da el símbolo Z . El número de electrones en un átomo eléctricamente neutro es el mismo que el número de protones en el núcleo. La carga eléctrica total del núcleo es, por tanto, + Ze , donde e (carga elemental) es igual a 1.602 x 10-19 culombios . Cada electrón está influenciado por los campos eléctricos producidos por la carga nuclear positiva y los otros electrones negativos (Z - 1) en el átomo.
Es el principio de exclusión de Pauli que requiere que los electrones de un átomo ocupen diferentes niveles de energía en lugar de que todos se condensen en el estado fundamental. El orden de los electrones en el estado fundamental de los átomos multielectrones comienza con el estado de energía más bajo (estado fundamental) y se mueve progresivamente desde allí hacia arriba en la escala de energía hasta que a cada uno de los electrones del átomo se le ha asignado un conjunto único de números cuánticos. Este hecho tiene implicaciones clave para la construcción de la tabla periódica de elementos.
[/ lgc_column]
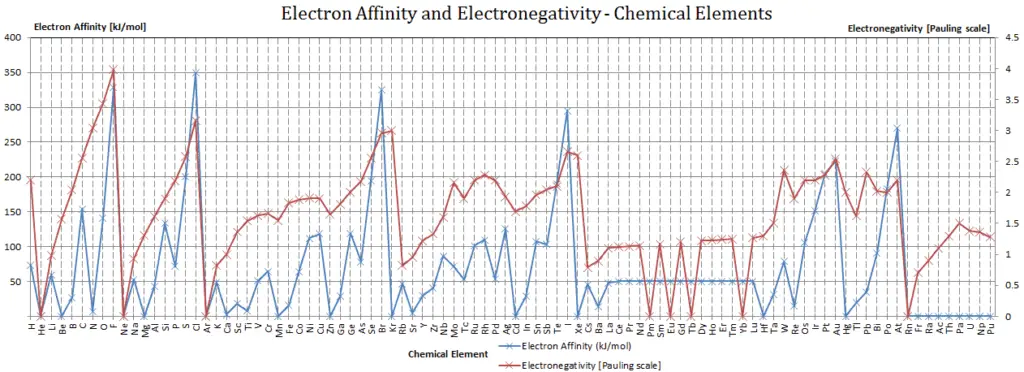
Afinidad electronica
En química y física atómica, la afinidad electrónica de un átomo o molécula se define como:
el cambio de energía (en kJ / mol) de un átomo o molécula neutro (en la fase gaseosa) cuando se agrega un electrón al átomo para formar un ion negativo .
X + e - → X - + energía Afinidad = - ∆H
En otras palabras, se puede expresar como la probabilidad del átomo neutro de ganar un electrón. Tenga en cuenta que las energías de ionización miden la tendencia de un átomo neutro a resistir la pérdida de electrones. Las afinidades electrónicas son más difíciles de medir que las energías de ionización.
Un átomo de flúor en la fase gaseosa, por ejemplo, emite energía cuando gana un electrón para formar un ion fluoruro.
F + e - → F - - ∆H = Afinidad = 328 kJ / mol
Para utilizar correctamente las afinidades electrónicas , es fundamental realizar un seguimiento del signo. Cuando se agrega un electrón a un átomo neutro, se libera energía. Esta afinidad se conoce como la primera afinidad electrónica y estas energías son negativas. Por convención, el signo negativo muestra una liberación de energía. Sin embargo, se requiere más energía para agregar un electrón a un ión negativo que supera cualquier liberación de energía del proceso de unión de electrones. Esta afinidad se conoce como afinidad del segundo electrón y estas energías son positivas.
Afinidades de los no metales frente a las afinidades de los metales
- Metales : A los metales les gusta perder electrones de valencia para formar cationes y tener una capa completamente estable. La afinidad electrónica de los metales es menor que la de los no metales. Mercurio atrae más débilmente un electrón extra.
- No metales : generalmente, los no metales tienen una afinidad electrónica más positiva que los metales. A los no metales les gusta ganar electrones para formar aniones y tener una capa de electrones completamente estable. El cloro atrae con más fuerza electrones adicionales. Las afinidades electrónicas de los gases nobles no se han medido de manera concluyente, por lo que pueden tener o no valores ligeramente negativos.
[/ lgc_column]
Electronegatividad
La electronegatividad , símbolo χ, es una propiedad química que describe la tendencia de un átomo a atraer electrones hacia este átomo. Para este propósito, una cantidad adimensional, la escala de Pauling , símbolo χ, es la más utilizada.
La electronegatividad del flúor es:
χ = 4.0
En general, la electronegatividad de un átomo se ve afectada tanto por su número atómico como por la distancia a la que residen sus electrones de valencia del núcleo cargado. Cuanto mayor sea el número de electronegatividad asociado, más un elemento o compuesto atrae electrones hacia él.
Al átomo más electronegativo, el flúor, se le asigna un valor de 4,0, y los valores van hasta cesio y francio, que son los menos electronegativos con 0,7.
[/ lgc_column]
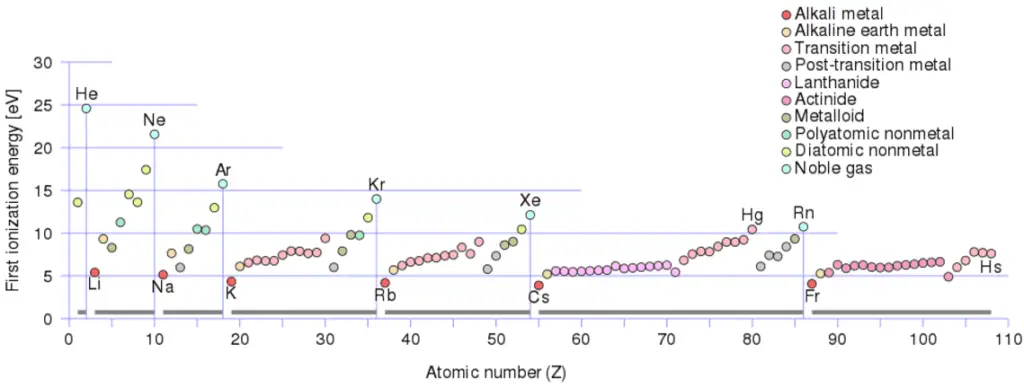
Energía de ionización
La energía de ionización , también llamada potencial de ionización , es la energía necesaria para eliminar un electrón del átomo neutro.
X + energía → X + + e -
donde X es cualquier átomo o molécula capaz de ionizarse, X + es ese átomo o molécula con un electrón eliminado (ion positivo) y e - es el electrón eliminado.
Un átomo de nitrógeno, por ejemplo, requiere la siguiente energía de ionización para eliminar el electrón más externo.
N + IE → N + + e - IE = 14,5 eV
La energía de ionización asociada con la eliminación del primer electrón es la más utilizada. El n energía º ionización se refiere a la cantidad de energía requerida para quitar un electrón de la especie con una carga de ( n -1).
1a energía de ionización
X → X + + e -
2da energía de ionización
X + → X 2+ + e -
3a energía de ionización
X 2+ → X 3+ + e -
Energía de ionización para diferentes elementos
Hay una energía de ionización por cada electrón sucesivo eliminado. Los electrones que rodean el núcleo se mueven en órbitas bastante bien definidas. Algunos de estos electrones están más unidos al átomo que otros. Por ejemplo, solo se requieren 7,38 eV para eliminar el electrón más externo de un átomo de plomo, mientras que se requieren 88,000 eV para eliminar el electrón más interno. Ayuda a comprender la reactividad de los elementos (especialmente los metales, que pierden electrones).
En general, la energía de ionización aumenta moviéndose hacia arriba en un grupo y moviéndose de izquierda a derecha a lo largo de un período. Es más:
- La energía de ionización es más baja para los metales alcalinos que tienen un solo electrón fuera de una capa cerrada.
- La energía de ionización aumenta a lo largo de una fila en el máximo periódico de los gases nobles que tienen capas cerradas.
Por ejemplo, el sodio requiere solo 496 kJ / mol o 5,14 eV / átomo para ionizarlo. Por otro lado, el neón, el gas noble, que lo precede inmediatamente en la tabla periódica, requiere 2081 kJ / mol o 21,56 eV / átomo.
[/ lgc_column]
- JR Lamarsh, Introducción a la teoría de los reactores nucleares, 2ª ed., Addison-Wesley, Reading, MA (1983).
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
- WM Stacey, Física de reactores nucleares, John Wiley & Sons, 2001, ISBN: 0-471-39127-1.
- Glasstone, Sesonske. Ingeniería de Reactores Nucleares: Ingeniería de Sistemas de Reactores, Springer; 4a edición, 1994, ISBN: 978-0412985317
- WSC Williams. Física nuclear y de partículas. Prensa de Clarendon; 1 edición, 1991, ISBN: 978-0198520467
- GRKeepin. Física de la cinética nuclear. Addison-Wesley Pub. Co; 1a edición, 1965
- Robert Reed Burn, Introducción a la operación de reactores nucleares, 1988.
- Departamento de Energía, Física Nuclear y Teoría de Reactores de EE. UU. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Paul Reuss, Física de neutrones. EDP Sciences, 2008. ISBN: 978-2759800414.
Física avanzada de reactores:
- KO Ott, WA Bezella, Introductory Nuclear Reactor Statics, American Nuclear Society, edición revisada (1989), 1989, ISBN: 0-894-48033-2.
- KO Ott, RJ Neuhold, Introducción a la dinámica de los reactores nucleares, Sociedad Nuclear Estadounidense, 1985, ISBN: 0-894-48029-4.
- DL Hetrick, Dinámica de los reactores nucleares, Sociedad Nuclear Estadounidense, 1993, ISBN: 0-894-48453-2.
- EE Lewis, WF Miller, Métodos computacionales de transporte de neutrones, American Nuclear Society, 1993, ISBN: 0-894-48452-4.
[/ su_spoiler]
[/ lgc_column]Ver también:
Atom [/ su_button] [/ lgc_column] [ lgc_column grid = "33" tablet_grid = "33" mobile_grid = "100" last = "false"] [/ lgc_column]
Esperamos que este artículo, Elementos químicos , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.