Qu’est-ce que l’ionisation
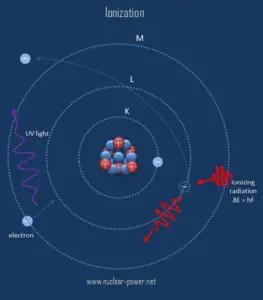 L’ionisation est le processus par lequel un atome ou une molécule gagne ou perd des électrons pour former un ion chargé. L’ionisation peut résulter de la perte d’un électron après des collisions avec des particules subatomiques énergétiques, des collisions avec d’autres atomes, molécules et ions, ou par l’interaction avec un rayonnement électromagnétique. En général, le rayonnement ionisant est tout rayonnement (particules ou ondes électromagnétiques) qui transporte suffisamment d’énergie pour faire tomber les électrons des atomes ou des molécules, les ionisant ainsi. Pour les rayonnements ionisants, l’énergie cinétique des particules (photons, électrons, etc.) est suffisante et la particule peut ioniser (pour former des ions en perdant des électrons) les atomes cibles pour former des ions.
L’ionisation est le processus par lequel un atome ou une molécule gagne ou perd des électrons pour former un ion chargé. L’ionisation peut résulter de la perte d’un électron après des collisions avec des particules subatomiques énergétiques, des collisions avec d’autres atomes, molécules et ions, ou par l’interaction avec un rayonnement électromagnétique. En général, le rayonnement ionisant est tout rayonnement (particules ou ondes électromagnétiques) qui transporte suffisamment d’énergie pour faire tomber les électrons des atomes ou des molécules, les ionisant ainsi. Pour les rayonnements ionisants, l’énergie cinétique des particules (photons, électrons, etc.) est suffisante et la particule peut ioniser (pour former des ions en perdant des électrons) les atomes cibles pour former des ions.
La frontière entre les rayonnements ionisants et non ionisants n’est pas clairement définie, car différentes molécules et atomes s’ionisent à différentes énergies. Les rayons gamma, les rayons X et la partie ultraviolette supérieure du spectre sont ionisants, tandis que les ultraviolets inférieurs, la lumière visible (y compris la lumière laser), les infrarouges, les micro-ondes et les ondes radio sont considérés comme des rayonnements non ionisants.
Énergie d’ionisation
L’énergie d’ionisation, également appelée potentiel d’ionisation, est l’énergie nécessaire pour retirer un électron de l’atome neutre.
X + énergie → X+ + e−
où X est n’importe quel atome ou molécule capable d’être ionisé, X+ est cet atome ou molécule avec un électron retiré (ion positif), et e– est l’électron retiré.
Un atome d’azote, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus externe.
N + IE → N+ + e– IE = 14,5 eV
L’énergie d’ionisation associée à l’élimination du premier électron est la plus couramment utilisée. La n ième énergie d’ionisation fait référence à la quantité d’énergie nécessaire pour éliminer un électron de l’espèce avec une charge de ( n -1).
1ère énergie d’ionisation
X → X + + e −
2ème énergie d’ionisation
X + → X 2+ + e −
3ème énergie d’ionisation
X 2+ → X 3+ + e −
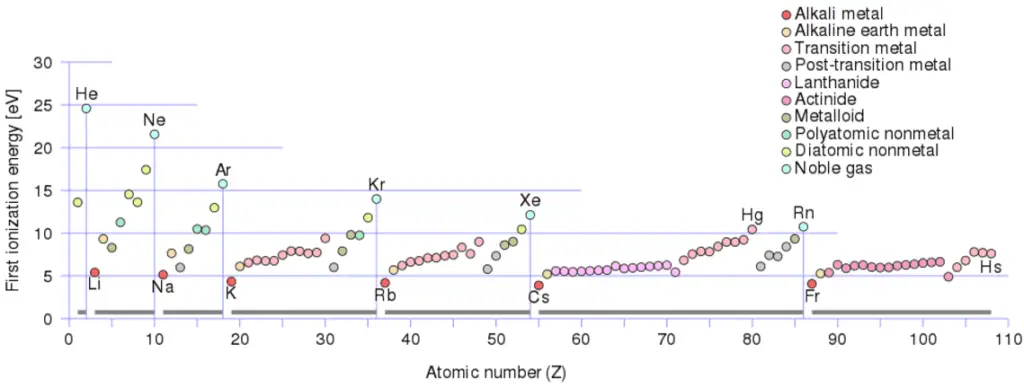
Énergie d’ionisation pour différents éléments
Il existe une énergie d’ionisation pour chaque électron successif éliminé. Les électrons qui entourent le noyau se déplacent sur des orbites assez bien définies. Certains de ces électrons sont plus étroitement liés dans l’atome que d’autres. Par exemple, seulement 7,38 eV sont nécessaires pour éliminer l’électron le plus externe d’un atome de plomb, tandis que 88 000 eV sont nécessaires pour éliminer l’électron le plus interne. Aide à comprendre la réactivité des éléments (en particulier les métaux, qui perdent des électrons).
En général, l’énergie d’ionisation augmente en remontant d’un groupe et en se déplaçant de gauche à droite sur une période. En outre:
- L’énergie d’ionisation est la plus faible pour les métaux alcalins qui ont un seul électron à l’extérieur d’une coquille fermée.
- L’énergie d’ionisation augmente sur une ligne sur le maximum périodique pour les gaz nobles qui ont des coquilles fermées
Par exemple, le sodium ne nécessite que 496 kJ/mol ou 5,14 eV/atome pour l’ioniser. Par contre le néon, le gaz rare qui le précède immédiatement dans le tableau périodique, nécessite 2081 kJ/mol ou 21,56 eV/atome.
Nous espérons que cet article, Ionisation, vous aide. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.