¿Qué es la ionización?
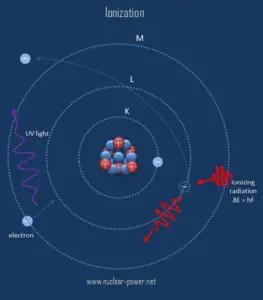 La ionización es el proceso por el cual un átomo o una molécula gana o pierde electrones para formar un ión cargado. La ionización puede resultar de la pérdida de un electrón después de colisiones con partículas subatómicas energéticas, colisiones con otros átomos, moléculas e iones, o mediante la interacción con radiación electromagnética. En general, la radiación ionizante es cualquier radiación (partículas u ondas electromagnéticas) que transporta suficiente energía para golpear los electrones de los átomos o moléculas, ionizándolos así. Para la radiación ionizante, la energía cinética de las partículas ( fotones, electrones, etc. ) es suficiente y la partícula puede ionizar (para formar iones perdiendo electrones) átomos objetivo para formar iones.
La ionización es el proceso por el cual un átomo o una molécula gana o pierde electrones para formar un ión cargado. La ionización puede resultar de la pérdida de un electrón después de colisiones con partículas subatómicas energéticas, colisiones con otros átomos, moléculas e iones, o mediante la interacción con radiación electromagnética. En general, la radiación ionizante es cualquier radiación (partículas u ondas electromagnéticas) que transporta suficiente energía para golpear los electrones de los átomos o moléculas, ionizándolos así. Para la radiación ionizante, la energía cinética de las partículas ( fotones, electrones, etc. ) es suficiente y la partícula puede ionizar (para formar iones perdiendo electrones) átomos objetivo para formar iones.
El límite entre la radiación ionizante y no ionizante no está claramente definido, ya que diferentes moléculas y átomos se ionizan a diferentes energías. Los rayos gamma , los rayos X y la parte ultravioleta superior del espectro son ionizantes, mientras que el ultravioleta inferior, la luz visible (incluida la luz láser), el infrarrojo, las microondas y las ondas de radio se consideran radiación no ionizante.
Energía de ionización
La energía de ionización , también llamada potencial de ionización , es la energía necesaria para eliminar un electrón del átomo neutro.
X + energía → X + + e –
donde X es cualquier átomo o molécula capaz de ionizarse, X + es ese átomo o molécula con un electrón eliminado (ion positivo) y e – es el electrón eliminado.
Un átomo de nitrógeno, por ejemplo, requiere la siguiente energía de ionización para eliminar el electrón más externo.
N + IE → N + + e – IE = 14,5 eV
La energía de ionización asociada con la eliminación del primer electrón es la más utilizada. El n energía º ionización se refiere a la cantidad de energía requerida para quitar un electrón de la especie con una carga de ( n -1).
1a energía de ionización
X → X + + e –
2da energía de ionización
X + → X 2+ + e –
3a energía de ionización
X 2+ → X 3+ + e –
Energía de ionización para diferentes elementos
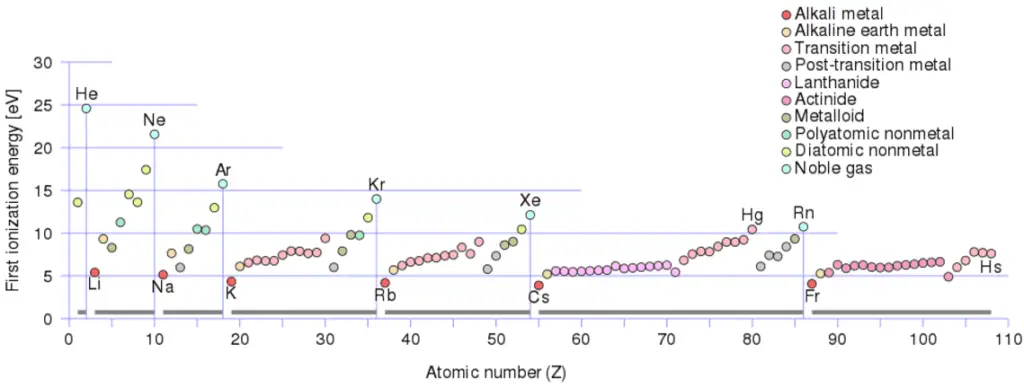
Hay una energía de ionización por cada electrón sucesivo eliminado. Los electrones que rodean el núcleo se mueven en órbitas bastante bien definidas. Algunos de estos electrones están más unidos al átomo que otros. Por ejemplo, solo se requieren 7,38 eV para eliminar el electrón más externo de un átomo de plomo, mientras que se requieren 88,000 eV para eliminar el electrón más interno. Ayuda a comprender la reactividad de los elementos (especialmente los metales, que pierden electrones).
En general, la energía de ionización aumenta moviéndose hacia arriba en un grupo y moviéndose de izquierda a derecha a lo largo de un período. Es más:
- La energía de ionización es más baja para los metales alcalinos que tienen un solo electrón fuera de una capa cerrada.
- La energía de ionización aumenta a lo largo de una fila en el máximo periódico de los gases nobles que tienen capas cerradas.
Por ejemplo, el sodio requiere solo 496 kJ / mol o 5,14 eV / átomo para ionizarlo. Por otro lado, el neón, el gas noble, que lo precede inmediatamente en la tabla periódica, requiere 2081 kJ / mol o 21,56 eV / átomo.
Esperamos que este artículo, Ionización , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.