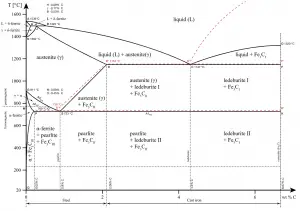
A ferrita ou α-ferrita é uma fase de estrutura cúbica de corpo centrado do ferro que existe abaixo de temperaturas de 912°C para baixas concentrações de carbono no ferro. A α-ferrita só pode dissolver até 0,02% do carbono a 727°C. Isso ocorre devido à configuração da rede de ferro que forma uma estrutura cristalina BCC. Em um arranjo de átomos bcc (BCC), a célula unitária consiste em oito átomos nos cantos de um cubo e um átomo no centro do corpo do cubo. Em um arranjo bcc, uma célula unitária contém (8 átomos de canto × ⅛) + (1 átomo central × 1) = 2 átomos. O empacotamento é mais eficiente (68%) do que o cúbico simples e a estrutura é comum para metais alcalinos e metais de transição iniciais.
A fase primária de baixo teor de carbono ou aço macio e a maioria dos ferros fundidos à temperatura ambiente é α-Fe ferromagnético. Tem uma dureza de aproximadamente 80 Brinell. Aço doce (aço carbono com até cerca de 0,2% em peso C) consiste principalmente de α-Fe e quantidades crescentes de cementita (Fe3C, um carboneto de ferro). A mistura adota uma estrutura laminar chamada perlita. Como a bainita e a perlita contêm α-Fe como componente, qualquer liga de ferro-carbono conterá alguma quantidade de α-Fe se for permitido atingir o equilíbrio à temperatura ambiente. A quantidade de α-Fe depende do processo de resfriamento.
d-ferrita
A fase δ-ferrita tem uma estrutura semelhante, uma estrutura cristalina cúbica de corpo centrado (BCC), como a da α-ferrita, mas existe apenas em altas temperaturas. A fase pode ser vista no canto superior esquerdo do gráfico. Tem um ponto de fusão de 1538 °C.
Aço de baixo carbono
O aço de baixo teor de carbono, também conhecido como aço macio, é agora a forma mais comum de aço porque seu preço é relativamente baixo, ao mesmo tempo em que fornece propriedades de material aceitáveis para muitas aplicações. O aço de baixo carbono contém aproximadamente 0,05–0,25% de carbono, tornando-o maleável e dúctil. O aço macio tem uma resistência à tração relativamente baixa, mas é barato e fácil de formar; a dureza da superfície pode ser aumentada através da cementação.

Aplicações típicas incluem componentes de carrocerias de automóveis, formas estruturais (por exemplo, vigas em I, canais e cantoneiras) e chapas usadas em tubulações e edifícios. Por exemplo, o aço A36 é um aço estrutural comum nos Estados Unidos. Chapas de aço de baixo carbono usadas para aplicações em carrocerias, por exemplo, são submetidas a uma variedade de operações de conformação, incluindo estampagem profunda. As microestruturas consistem em constituintes de ferrita e perlita. Como consequência, essas ligas são relativamente macias e fracas, mas possuem excelente ductilidade e tenacidade. Além disso, eles são usináveis, soldáveis e, de todos os aços, são os menos caros de produzir. A densidade deste metal é de 7861,093 kg/m³ (0,284 lb/in³) e a resistência à tração é de no máximo 500 MPa (72500 psi).
Aço Inoxidável Ferrítico
Nos aços inoxidáveis ferríticos, o carbono é mantido em níveis baixos (C<0,08%) e o teor de cromo pode variar de 10,50 a 30,00%. Elas são chamadas de ligas ferríticas porque contêm principalmente microestruturas ferríticas em todas as temperaturas e não podem ser endurecidas por meio de tratamento térmico e têmpera. Eles são classificados com as designações da série AISI 400. Enquanto alguns graus ferríticos contêm molibdênio (até 4,00%), apenas o cromo está presente como o principal elemento de liga metálica. Eles são geralmente limitados em uso a seções relativamente finas devido à falta de tenacidade nas soldas. Além disso, eles têm resistência a altas temperaturas relativamente fraca. Os aços ferríticos são escolhidos por sua resistência à corrosão sob tensão, o que os torna uma alternativa atraente aos aços inoxidáveis austeníticos em aplicações onde a SCC induzida por cloreto é predominante.
Outras fases comuns em aços e ferros
O tratamento térmico de aços requer uma compreensão tanto das fases de equilíbrio quanto das fases metaestáveis que ocorrem durante o aquecimento e/ou resfriamento. Para os aços, as fases de equilíbrio estável incluem:
- Ferrita. A ferrita ou α-ferrita é uma fase de estrutura cúbica de corpo centrado do ferro que existe abaixo de temperaturas de 912°C para baixas concentrações de carbono no ferro. A α-ferrita só pode dissolver até 0,02% do carbono a 727°C. Isso ocorre devido à configuração da rede de ferro que forma uma estrutura cristalina BCC. A fase primária de baixo teor de carbono ou aço macio e a maioria dos ferros fundidos à temperatura ambiente é α-Fe ferromagnético.
- Austenita. A austenita, também conhecida como ferro de fase gama (γ-Fe), é uma fase de estrutura cúbica de face centrada não magnética do ferro. A austenita em ligas de ferro-carbono geralmente está presente apenas acima da temperatura eutetóide crítica (723°C) e abaixo de 1500°C, dependendo do teor de carbono. No entanto, pode ser mantido à temperatura ambiente por adições de ligas como níquel ou manganês. O carbono desempenha um papel importante no tratamento térmico, porque expande a faixa de temperatura de estabilidade da austenita. O teor de carbono mais alto reduz a temperatura necessária para austenitizar o aço – de modo que os átomos de ferro se rearranjam para formar uma estrutura de treliça FCC. A austenita está presente no tipo de aço inoxidável mais comumente usado, que é muito conhecido por sua resistência à corrosão.
- Grafite. Adicionar uma pequena quantidade de carbono não metálico ao ferro troca sua grande ductilidade por maior resistência.
- Cementita. A cementita (Fe3C) é um composto metaestável e, em algumas circunstâncias, pode se dissociar ou se decompor para formar α-ferrita e grafite, de acordo com a reação: Fe3C → 3Fe (α) + C (grafite). A cementita em sua forma pura é uma cerâmica e é dura e quebradiça, o que a torna adequada para o reforço de aços. Suas propriedades mecânicas são função de sua microestrutura, que depende de como ele é misturado com a ferrita.
As fases metaestáveis são:
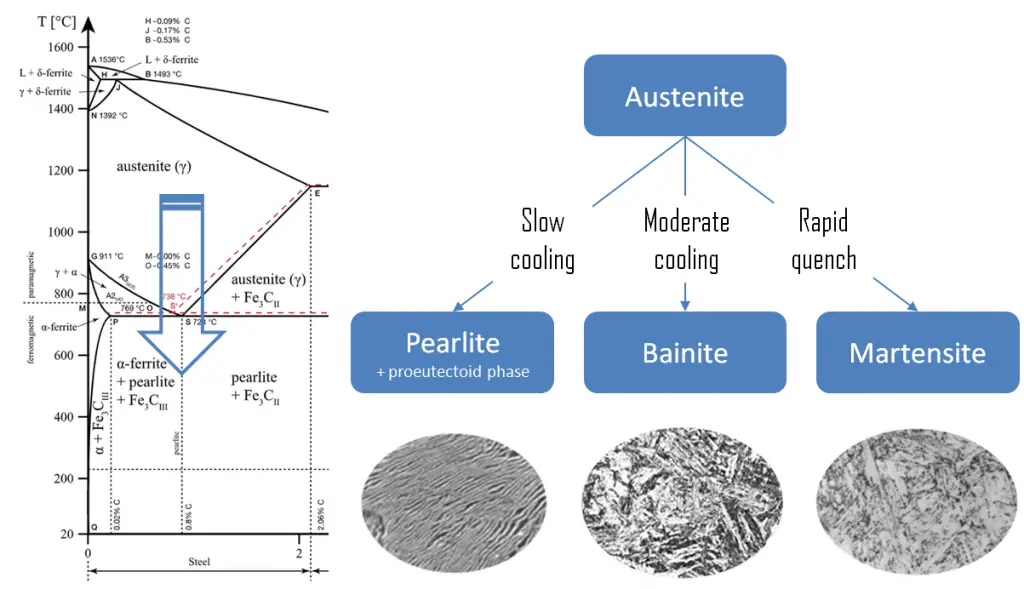 Perlita. Na metalurgia, a perlita é uma estrutura metálica em camadas de duas fases, composta por camadas alternadas de ferrita (87,5% em peso) e cementita (12,5% em peso) que ocorre em alguns aços e ferros fundidos. É nomeado por sua semelhança com a madrepérola.
Perlita. Na metalurgia, a perlita é uma estrutura metálica em camadas de duas fases, composta por camadas alternadas de ferrita (87,5% em peso) e cementita (12,5% em peso) que ocorre em alguns aços e ferros fundidos. É nomeado por sua semelhança com a madrepérola.- Martensita. A martensita é uma estrutura metaestável muito dura com uma estrutura cristalina tetragonal de corpo centrado (BCT). A martensita é formada nos aços quando a taxa de resfriamento da austenita é tão alta que os átomos de carbono não têm tempo de se difundir para fora da estrutura cristalina em quantidades suficientes para formar a cementita (Fe3C).
- Bainita. A bainita é uma microestrutura semelhante a uma placa que se forma nos aços a partir da austenita quando as taxas de resfriamento não são rápidas o
suficiente para produzir martensita, mas ainda são rápidas o suficiente para que o carbono não tenha tempo suficiente para se difundir para formar a perlita. Os aços bainíticos são geralmente mais fortes e duros que os aços perlíticos; ainda assim, exibem uma combinação desejável de resistência e ductilidade.
Departamento de Energia dos EUA, Ciência de Materiais. DOE Fundamentals Handbook, Volume 1 e 2. Janeiro de 1993.
Departamento de Energia dos EUA, Ciência de Materiais. DOE Fundamentals Handbook, Volume 2 e 2. Janeiro de 1993.
William D. Callister, David G. Rethwisch. Ciência e Engenharia de Materiais: Uma Introdução 9ª Edição, Wiley; 9 edição (4 de dezembro de 2013), ISBN-13: 978-1118324578.
Eberhart, Mark (2003). Por que as coisas quebram: entendendo o mundo pela maneira como ele se desfaz. Harmonia. ISBN 978-1-4000-4760-4.
Gaskell, David R. (1995). Introdução à Termodinâmica dos Materiais (4ª ed.). Editora Taylor e Francis. ISBN 978-1-56032-992-3.
González-Viñas, W. & Mancini, HL (2004). Uma Introdução à Ciência dos Materiais. Princeton University Press. ISBN 978-0-691-07097-1.
Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiais: engenharia, ciência, processamento e design (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
JR Lamarsh, AJ Baratta, Introdução à Engenharia Nuclear, 3ª ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
Esperamos que este artigo, Ferrite, ajude você. Se sim, dê um like na barra lateral. O objetivo principal deste site é ajudar o público a aprender algumas informações interessantes e importantes sobre materiais e suas propriedades.