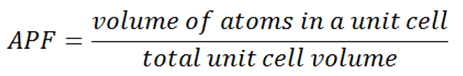Algunas de las propiedades de los sólidos cristalinos dependen de la estructura cristalina del material, la forma en que los átomos, iones o moléculas están dispuestos espacialmente. Una red de cristal es un patrón repetitivo de puntos matemáticos que se extiende por todo el espacio. Las fuerzas de los enlaces químicos provocan esta repetición. Es este patrón repetido el que controla propiedades como resistencia , ductilidad , densidad , conductividad (propiedad de conducir o transmitir calor, electricidad, etc.) y forma . Hay 14 tipos generales de patrones conocidos como celosías de Bravais .
Se encuentran tres estructuras cristalinas relativamente simples para la mayoría de los metales comunes:
-
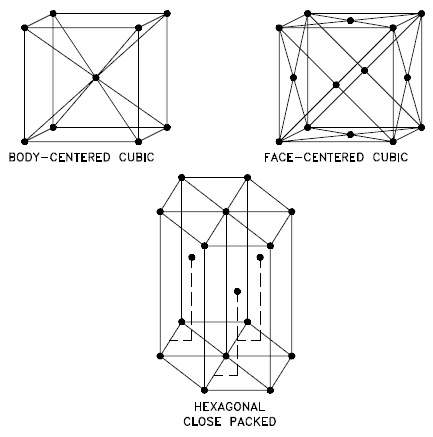
Fuente: Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993. Cúbico centrado en el cuerpo - bcc. En una disposición de átomos cúbica centrada en el cuerpo (bcc), la celda unitaria consta de ocho átomos en las esquinas de un cubo y un átomo en el centro del cuerpo del cubo. En una disposición bcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (1 átomo central × 1) = 2 átomos. El empaque es más eficiente (68%) que el cúbico simple y la estructura es común para metales alcalinos y metales de transición tempranos. Los metales que contienen estructuras de BCC incluyen ferrita, cromo, vanadio, molibdeno y tungsteno. Estos metales poseen alta resistencia y baja ductilidad.
- Cúbico centrado en la cara - fcc. En una disposición de átomos cúbica centrada en las caras (fcc), la celda unitaria consta de ocho átomos en las esquinas de un cubo y un átomo en el centro de cada una de las caras del cubo. En una disposición fcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (6 átomos de cara × ½) = 4 átomos. Esta estructura, junto con su pariente hexagonal (hcp), tiene el empaque más eficiente (74%). Los metales que contienen estructuras de FCC incluyen austenita, aluminio, cobre, plomo, plata, oro, níquel, platino y torio. Estos metales poseen baja resistencia y alta ductilidad.
- Hexagonal compacto - hcp. En una disposición hexagonal de átomos compactos (hcp), la celda unitaria consta de tres capas de átomos. Las capas superior e inferior contienen seis átomos en las esquinas de un hexágono y un átomo en el centro de cada hexágono. La capa intermedia contiene tres átomos ubicados entre los átomos de las capas superior e inferior, de ahí el nombre de empaquetado compacto. El empaquetamiento cerrado hexagonal (hcp) es uno de los dos tipos simples de empaquetamiento atómico con la densidad más alta, siendo el otro el cúbico centrado en la cara (fcc). Sin embargo, a diferencia de la fcc, no es una celosía de Bravais, ya que hay dos conjuntos de puntos de celosía no equivalentes. Los metales que contienen estructuras de HCP incluyen berilio, magnesio, zinc, cadmio, cobalto, talio y circonio. Los metales HCP no son tan dúctiles como los metales FCC.
Factor de empaque atómico - APF
En cristalografía, el factor de empaquetamiento atómico (APF) , la eficiencia de empaquetamiento o la fracción de empaquetamiento es la suma de los volúmenes de esfera de todos los átomos dentro de una celda unitaria (asumiendo el modelo atómico de esfera dura) dividido por el volumen de la celda unitaria.
Por convención, el APF se determina asumiendo que los átomos son esferas rígidas. El radio de las esferas se toma como el valor máximo para que los átomos no se superpongan. En la ciencia de los materiales , el factor de empaquetamiento atómico de una celda unitaria explica muchas propiedades de los materiales. Por ejemplo, los metales con un factor de empaquetamiento atómico alto tendrán una mayor maleabilidad o ductilidad, similar a cómo una carretera es más suave cuando las piedras están más juntas, lo que permite que los átomos de metal se deslicen entre sí con mayor facilidad.
Por ejemplo, en una disposición fcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (6 átomos de cara × ½) = 4 átomos. Esta estructura, junto con su pariente hexagonal (hcp), tiene el empaque más eficiente (74%).
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
Esperamos que este artículo, Crystal Lattice , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.