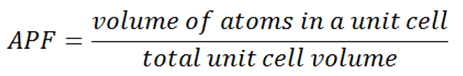Certaines des propriétés des solides cristallins dépendent de la structure cristalline du matériau, de la manière dont les atomes, les ions ou les molécules sont disposés dans l’espace. Un réseau cristallin est un motif répétitif de points mathématiques qui s’étend dans tout l’espace. Les forces de la liaison chimique provoquent cette répétition. C’est ce motif répété qui contrôle les propriétés telles que la résistance, la ductilité, la densité, la conductivité (propriété de conduire ou de transmettre la chaleur, l’électricité, etc.) et la forme. Il existe 14 types généraux de tels motifs connus sous le nom de réseaux de Bravais.
Trois structures cristallines relativement simples se retrouvent pour la plupart des métaux courants:
-
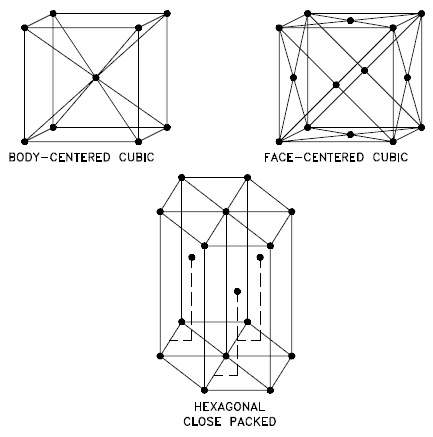
Source: Département américain de l’énergie, Science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993. Cubique centré sur le corps – bcc. Dans un arrangement d’atomes cubique centré sur le corps (bcc), la cellule unitaire se compose de huit atomes aux coins d’un cube et d’un atome au centre du corps du cube. Dans un arrangement bcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (1 atome central × 1) = 2 atomes. Le garnissage est plus efficace (68%) que le simple cubique et la structure est courante pour les métaux alcalins et les métaux de transition précoce. Les métaux contenant des structures BCC comprennent la ferrite, le chrome, le vanadium, le molybdène et le tungstène. Ces métaux possèdent une résistance élevée et une faible ductilité.
- Cubique à faces centrées – fcc. Dans un arrangement d’atomes cubique à faces centrées (fcc), la cellule unitaire se compose de huit atomes aux coins d’un cube et d’un atome au centre de chacune des faces du cube. Dans un arrangement fcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (6 atomes de face × ½) = 4 atomes. Cette structure, avec son parent hexagonal (hcp), a le garnissage le plus efficace (74%). Les métaux contenant des structures FCC comprennent l’austénite, l’aluminium, le cuivre, le plomb, l’argent, l’or, le nickel, le platine et le thorium. Ces métaux possèdent une faible résistance et une ductilité élevée.
- Hexagonal Compact – hcp. Dans un arrangement d’atomes hexagonal compact (hcp), la cellule unitaire est constituée de trois couches d’atomes. Les couches supérieure et inférieure contiennent six atomes aux coins d’un hexagone et un atome au centre de chaque hexagone. La couche intermédiaire contient trois atomes nichés entre les atomes des couches supérieure et inférieure, d’où le nom de compact. Hexagonal Close Packed (hcp) est l’un des deux types simples de garnissage atomique avec la densité la plus élevée, l’autre étant le cubique à faces centrées (fcc). Cependant, contrairement au fcc, ce n’est pas un réseau de Bravais car il existe deux ensembles non équivalents de points de réseau. Les métaux contenant des structures HCP comprennent le béryllium, le magnésium, le zinc, le cadmium, le cobalt, le thallium et le zirconium. Les métaux HCP ne sont pas aussi ductiles que les métaux FCC.
Facteur de tassement atomique – APF
En cristallographie, le facteur de garnissage atomique (APF), l’efficacité de garnissage ou la fraction de garnissage est la somme des volumes de sphère de tous les atomes dans une cellule unitaire (en supposant le modèle de sphère dure atomique) divisé par le volume de la cellule unitaire.
Par convention, l’APF est déterminé en supposant que les atomes sont des sphères rigides. Le rayon des sphères est pris comme étant la valeur maximale telle que les atomes ne se chevauchent pas. En science des matériaux, le facteur de garnissage atomique d’une cellule unitaire explique de nombreuses propriétés des matériaux. Par exemple, les métaux avec un facteur de tassement atomique élevé auront une malléabilité ou une ductilité plus élevée, similaire à la façon dont une route est plus lisse lorsque les pierres sont plus proches les unes des autres, permettant aux atomes métalliques de glisser plus facilement les uns sur les autres.
Par exemple, dans un arrangement fcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (6 atomes de face × ½) = 4 atomes. Cette structure, avec son parent hexagonal (hcp), a le garnissage le plus efficace (74%).
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Crystal Lattice, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.