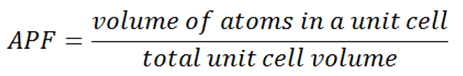En general, los sólidos se caracterizan por su rigidez estructural y resistencia a cambios de forma o volumen. A diferencia de un líquido, un objeto sólido no fluye para tomar la forma de su recipiente, ni se expande para llenar todo el volumen disponible como lo hace un gas. Los sólidos tienen mayores atracciones interatómicas que los líquidos y los gases. Sin embargo, existen amplias variaciones en las propiedades de los materiales sólidos utilizados con fines de ingeniería. Las propiedades de los materiales dependen de sus enlaces interatómicos . Estos mismos enlaces también dictan el espacio entre la configuración de los átomos en los sólidos. Todos los sólidos se pueden clasificar como:
- Sólidos amorfos . Los materiales amorfos, o sólidos no cristalinos, no tienen una disposición regular de sus moléculas y carecen del orden de largo alcance que es característico de los sólidos cristalinos. Los materiales amorfos tienen las propiedades de los sólidos, también se caracterizan por su rigidez estructural y resistencia a los cambios de forma o volumen. Tienen forma y volumen definidos y se difunden lentamente. Los materiales como el vidrio y la parafina se consideran amorfos. Estos materiales también carecen de puntos de fusión claramente definidos. En muchos aspectos, se parecen a los líquidos que fluyen muy lentamente a temperatura ambiente.
- Sólidos cristalinos . Los átomos de un sólido cristalino están estrechamente unidos entre sí, ya sea en una red geométrica regular (sólidos cristalinos, que incluyen metales y hielo ordinario).

Un material cristalino es aquel en el que los átomos están situados en una matriz periódica o repetida sobre grandes distancias atómicas, es decir, existe un orden de largo alcance, de modo que al solidificarse, los átomos se posicionarán en un patrón tridimensional repetitivo, en que cada átomo está unido a sus átomos vecinos más cercanos. No todos los sólidos son monocristales. Por ejemplo, cuando el agua líquida comienza a congelarse, el cambio de fase comienza con pequeños cristales de hielo que crecen hasta fusionarse, formando una estructura policristalina. En el bloque final de hielo, cada uno de los pequeños cristales (llamados » granos «) es un verdadero cristal con una disposición periódica de átomos, pero todo el policristal no tiene una disposición periódica de átomos, porque el patrón periódico se rompe en ellímites de grano .
Red cristalina
Algunas de las propiedades de los sólidos cristalinos dependen de la estructura cristalina del material, la forma en que los átomos, iones o moléculas están dispuestos espacialmente. Una red de cristal es un patrón repetitivo de puntos matemáticos que se extiende por todo el espacio. Las fuerzas de los enlaces químicos provocan esta repetición. Es este patrón repetido el que controla propiedades como resistencia , ductilidad , densidad , conductividad (propiedad de conducir o transmitir calor, electricidad, etc.) y forma . Hay 14 tipos generales de patrones conocidos como celosías de Bravais .
Se encuentran tres estructuras cristalinas relativamente simples para la mayoría de los metales comunes:
-
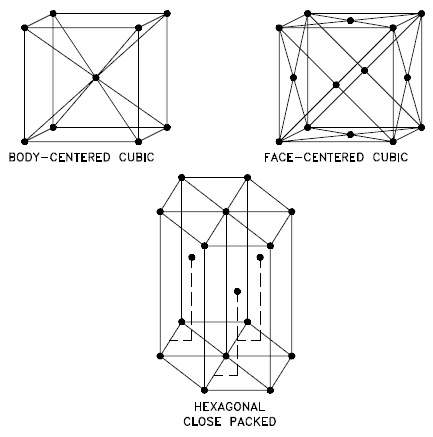
Fuente: Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993. Cúbico centrado en el cuerpo – bcc. En una disposición de átomos bcc (BCC), la celda unitaria consta de ocho átomos en las esquinas de un cubo y un átomo en el centro del cuerpo del cubo. En una disposición bcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (1 átomo central × 1) = 2 átomos. El empaque es más eficiente (68%) que el cúbico simple y la estructura es común para metales alcalinos y metales de transición tempranos. Los metales que contienen estructuras de BCC incluyen ferrita, cromo, vanadio, molibdeno y tungsteno. Estos metales poseen alta resistencia y baja ductilidad.
- Cúbico centrado en la cara – fcc. En una disposición de átomos fcc (FCC), la celda unitaria consta de ocho átomos en las esquinas de un cubo y un átomo en el centro de cada una de las caras del cubo. En una disposición fcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (6 átomos de cara × ½) = 4 átomos. Esta estructura, junto con su pariente hexagonal (hcp), tiene el empaque más eficiente (74%). Los metales que contienen estructuras de FCC incluyen austenita, aluminio, cobre, plomo, plata, oro, níquel, platino y torio. Estos metales poseen baja resistencia y alta ductilidad.
- Hexagonal compacto – hcp. En una disposición de átomos hcp (HCP), la celda unitaria consta de tres capas de átomos. Las capas superior e inferior contienen seis átomos en las esquinas de un hexágono y un átomo en el centro de cada hexágono. La capa intermedia contiene tres átomos ubicados entre los átomos de las capas superior e inferior, de ahí el nombre de empaquetado compacto. El empaquetamiento cerrado hexagonal (hcp) es uno de los dos tipos simples de empaquetamiento atómico con la densidad más alta, siendo el otro el cúbico centrado en la cara (fcc). Sin embargo, a diferencia de la fcc, no es una celosía de Bravais, ya que hay dos conjuntos de puntos de celosía no equivalentes. Los metales que contienen estructuras de HCP incluyen berilio, magnesio, zinc, cadmio, cobalto, talio y circonio. Los metales HCP no son tan dúctiles como los metales FCC.
Factor de empaque atómico – APF
En cristalografía, el factor de empaquetamiento atómico (APF) , la eficiencia de empaquetamiento o la fracción de empaquetamiento es la suma de los volúmenes de esfera de todos los átomos dentro de una celda unitaria (asumiendo el modelo atómico de esfera dura) dividido por el volumen de la celda unitaria.
Por convención, el APF se determina asumiendo que los átomos son esferas rígidas. El radio de las esferas se toma como el valor máximo para que los átomos no se superpongan. En la ciencia de los materiales , el factor de empaquetamiento atómico de una celda unitaria explica muchas propiedades de los materiales. Por ejemplo, los metales con un factor de empaquetamiento atómico alto tendrán una mayor maleabilidad o ductilidad, similar a cómo una carretera es más suave cuando las piedras están más juntas, lo que permite que los átomos de metal se deslicen entre sí con mayor facilidad.
Por ejemplo, en una disposición fcc, una celda unitaria contiene (8 átomos de esquina × ⅛) + (6 átomos de cara × ½) = 4 átomos. Esta estructura, junto con su pariente hexagonal (hcp), tiene el empaque más eficiente (74%).
Estructura de grano y límites de grano
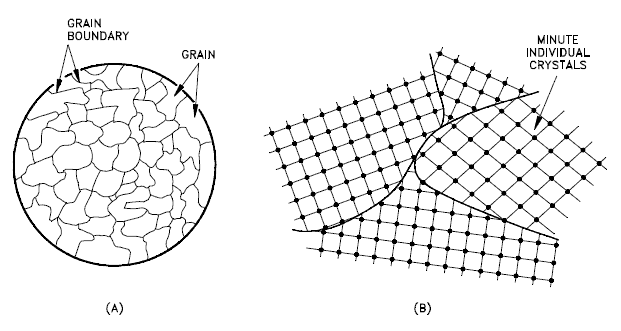
No todos los sólidos son monocristales (por ejemplo, semiconductores de silicio ). La mayoría de los sólidos cristalinos se componen de una colección de muchos cristales pequeños o granos de diferente tamaño y orientación. Estos tienen orientaciones cristalográficas aleatorias . Cuando un metal comienza con la cristalización, el cambio de fase comienza con pequeños cristales que crecen hasta fusionarse, formando una estructura policristalina . En el bloque final de material sólido, cada uno de los pequeños cristales (llamados » granos «) es un verdadero cristal con una disposición periódica de átomos, pero todo el policristal no tiene una disposición periódica de átomos, porque el patrón periódico se rompe en los límites del grano. Los granos y los límites de los granos ayudan a determinar las propiedades de un material.
- Los granos , también conocidos como cristalitos, son cristales pequeños o incluso microscópicos que se forman, por ejemplo, durante el enfriamiento de muchos materiales (cristalización). Una característica muy importante de un metal es el tamaño medio del grano. El tamaño del grano determina las propiedades del metal. Por ejemplo, un tamaño de grano más pequeño aumenta la resistencia a la tracción y tiende a aumentar la ductilidad. Se prefiere un tamaño de grano más grande para mejorar las propiedades de fluencia a alta temperatura. La fluencia es la deformación permanente que aumenta con el tiempo bajo carga o tensión constante. La fluencia se vuelve progresivamente más fácil con el aumento de temperatura.
- Límites de grano . El límite del grano se refiere al área exterior de un grano que lo separa de los otros granos. Los límites de los granos separan regiones cristalinas de orientación diversa (policristalinas) en las que las estructuras cristalinas son idénticas. Los límites de grano son defectos bidimensionales en la estructura cristalina y tienden a disminuir la conductividad eléctrica y térmica del material. La mayoría de los límites de grano son sitios preferidos para el inicio de la corrosión y para la precipitación de nuevas fases del sólido. También son importantes para muchos de los mecanismos de fluencia. Por otro lado, los límites de los granos interrumpen el movimiento de las dislocaciones.a través de un material. La propagación de la dislocación está impedida debido al campo de tensión de la región del defecto del límite de grano y la falta de planos de deslizamiento y direcciones de deslizamiento y alineación general a través de los límites. Por lo tanto, reducir el tamaño de los cristalitos es una forma común de mejorar la resistencia mecánica, porque los granos más pequeños crean más obstáculos por unidad de área del plano de deslizamiento.
Orientación de granos
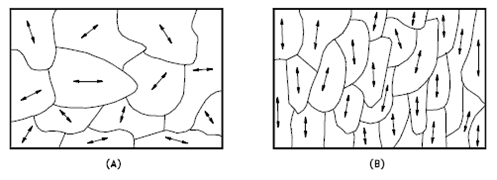
La orientación de los cristalitos puede ser aleatoria sin una dirección preferida, denominada textura aleatoria, o preferida, posiblemente debido a las condiciones de crecimiento y procesamiento. La orientación aleatoria se puede obtener mediante el laminado cruzado del material. Si una muestra de este tipo se laminase suficientemente en una dirección, podría desarrollar una estructura orientada al grano en la dirección de laminación. A esto se le llama orientación preferida . En muchos casos, la orientación preferida es muy deseable, pero en otros casos, puede ser más dañina. Por ejemplo, la orientación preferida en los elementos combustibles de uranio puede provocar cambios catastróficos en las dimensiones durante el uso en un reactor nuclear.
Referencia especial: Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
Polimorfismo y alotropía
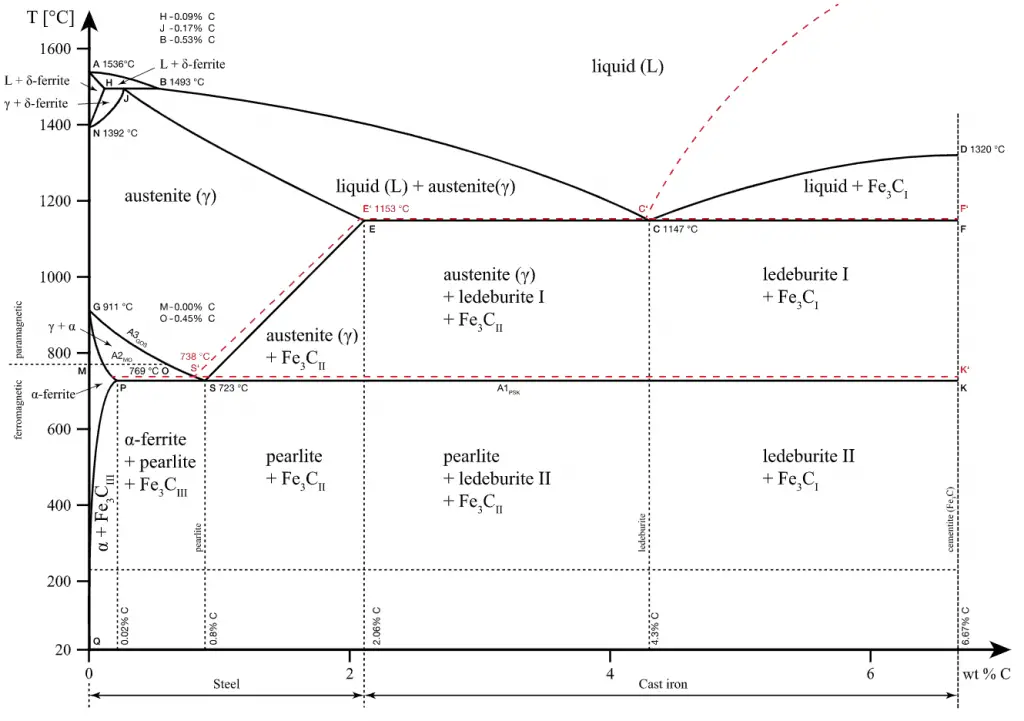
Algunos materiales cristalinos pueden tener más de una estructura cristalina , un fenómeno conocido como polimorfismo . El polimorfismo es la aparición de múltiples formas cristalinas de un material. Según las reglas de Gibbs de equilibrio de fases, estas fases cristalinas únicas dependen de variables intensivas como la thermodynamics/thermodynamic-properties/what-is-pressure-physics/»>presión y la temperatura . El polimorfismo está relacionado con la alotropía., que se refiere a elementos químicos. Eso significa que el polimorfismo es el término más general utilizado para cualquier material cristalino, incluidas las aleaciones y los elementos químicos. Cada polimorfo es de hecho un estado sólido termodinámico diferente y los polimorfos de cristal del mismo compuesto exhiben diferentes propiedades físicas, como velocidad de disolución, forma (ángulos entre facetas y tasas de crecimiento de facetas), punto de fusión, etc. Por esta razón, el polimorfismo es de de gran importancia en la fabricación industrial de productos cristalinos.
Un ejemplo familiar se encuentra en el carbono. El grafito (un sólido blando, negro, escamoso, un conductor eléctrico moderado) es el polimorfo estable en condiciones ambientales, mientras que el diamante (un cristal transparente extremadamente duro, con los átomos de carbono dispuestos en una red tetraédrica. Un mal conductor eléctrico. Excelente conductor térmico.) se forma a presiones extremadamente altas.
Además, el hierro puro tiene una estructura cristalina BCC a temperatura ambiente, que cambia a hierro FCC a 913 ° C. El circonio es HCP (alfa) hasta 863 ° C, donde se transforma en la forma BCC (beta, circonio). El problema es que estas transiciones de fase hacen que este material sea muy frágil .
Ver también: Oxidación con vapor a alta temperatura de aleaciones de circonio
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
Esperamos que este artículo, Crystal Structures , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.