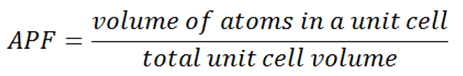En général, les solides se caractérisent par une rigidité structurelle et une résistance aux changements de forme ou de volume. Contrairement à un liquide, un objet solide ne s’écoule pas pour prendre la forme de son récipient, ni ne se dilate pour remplir tout le volume dont il dispose comme le fait un gaz. Les solides ont de plus grandes attractions interatomiques que les liquides et les gaz. Cependant, il existe de grandes variations dans les propriétés des matériaux solides utilisés à des fins d’ingénierie. Les propriétés des matériaux dépendent de leurs liaisons interatomiques. Ces mêmes liaisons dictent également l’espace entre la configuration des atomes dans les solides. Tous les solides peuvent être classés comme:
- Solides amorphes. Les matériaux amorphes, ou solides non cristallins, n’ont pas d’arrangement régulier de leurs molécules et n’ont pas l’ordre à longue distance caractéristique des solides cristallins. Les matériaux amorphes ont les propriétés des solides, ils se caractérisent également par une rigidité structurelle et une résistance aux changements de forme ou de volume. Ils ont une forme et un volume définis et se diffusent lentement. Les matériaux comme le verre et la paraffine sont considérés comme amorphes. Ces matériaux manquent également de points de fusion bien définis. À bien des égards, ils ressemblent à des liquides qui s’écoulent très lentement à température ambiante.
- Solides cristallins. Les atomes d’un solide cristallin sont étroitement liés les uns aux autres, soit dans un réseau géométrique régulier (solides cristallins, qui comprennent les métaux et la glace ordinaire).

Un matériau cristallin est un matériau dans lequel les atomes sont situés dans un réseau répétitif ou périodique sur de grandes distances atomiques, c’est-à-dire qu’il existe un ordre à longue portée, tel que lors de la solidification, les atomes se positionneront dans un motif tridimensionnel répétitif, en où chaque atome est lié à ses atomes voisins les plus proches. Tous les solides ne sont pas des monocristaux. Par exemple, lorsque l’eau liquide commence à geler, le changement de phase commence par de petits cristaux de glace qui se développent jusqu’à fusionner, formant une structure polycristalline. Dans le bloc de glace final, chacun des petits cristaux (appelés « grains« ) est un vrai cristal avec un arrangement périodique d’atomes, mais l’ensemble du polycristal n’a pas d’arrangement périodique d’atomes, car le motif périodique est brisé aujoints de grains.
Treillis de cristal
Certaines des propriétés des solides cristallins dépendent de la structure cristalline du matériau, de la manière dont les atomes, les ions ou les molécules sont disposés dans l’espace. Un réseau cristallin est un motif répétitif de points mathématiques qui s’étend dans tout l’espace. Les forces de la liaison chimique provoquent cette répétition. C’est ce motif répété qui contrôle les propriétés telles que la résistance, la ductilité, la densité, la conductivité (propriété de conduire ou de transmettre la chaleur, l’électricité, etc.) et la forme . Il existe 14 types généraux de tels motifs connus sous le nom de réseaux de Bravais.
Trois structures cristallines relativement simples se retrouvent pour la plupart des métaux courants:
-
Source: Département américain de l’énergie, Science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993. Cubique centré sur le corps – bcc. Dans un arrangement d’atomes bcc (BCC), la cellule unitaire se compose de huit atomes aux coins d’un cube et d’un atome au centre du corps du cube. Dans un arrangement bcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (1 atome central × 1) = 2 atomes. Le garnissage est plus efficace (68%) que le simple cubique et la structure est courante pour les métaux alcalins et les métaux de transition précoce. Les métaux contenant des structures BCC comprennent la ferrite, le chrome, le vanadium, le molybdène et le tungstène. Ces métaux possèdent une résistance élevée et une faible ductilité.
- Cubique à faces centrées – fcc. Dans un arrangement d’atomes fcc (FCC), la cellule unitaire se compose de huit atomes aux coins d’un cube et d’un atome au centre de chacune des faces du cube. Dans un arrangement fcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (6 atomes de face × ½) = 4 atomes. Cette structure, avec son parent hexagonal (hcp), a le garnissage le plus efficace (74%). Les métaux contenant des structures FCC comprennent l’austénite, l’aluminium, le cuivre, le plomb, l’argent, l’or, le nickel, le platine et le thorium. Ces métaux possèdent une faible résistance et une ductilité élevée.
- Hexagonal Compact – hcp. Dans un arrangement d’atomes hcp (HCP), la cellule unitaire est constituée de trois couches d’atomes. Les couches supérieure et inférieure contiennent six atomes aux coins d’un hexagone et un atome au centre de chaque hexagone. La couche intermédiaire contient trois atomes nichés entre les atomes des couches supérieure et inférieure, d’où le nom de compact. Hexagonal Close Packed (hcp) est l’un des deux types simples de garnissage atomique avec la densité la plus élevée, l’autre étant le cubique à faces centrées (fcc). Cependant, contrairement au fcc, ce n’est pas un réseau de Bravais car il existe deux ensembles non équivalents de points de réseau. Les métaux contenant des structures HCP comprennent le béryllium, le magnésium, le zinc, le cadmium, le cobalt, le thallium et le zirconium. Les métaux HCP ne sont pas aussi ductiles que les métaux FCC.
Facteur de tassement atomique – APF
En cristallographie, le facteur de garnissage atomique (APF), l’efficacité de garnissage ou la fraction de garnissage est la somme des volumes de sphère de tous les atomes dans une cellule unitaire (en supposant le modèle de sphère dure atomique) divisé par le volume de la cellule unitaire.
Par convention, l’APF est déterminé en supposant que les atomes sont des sphères rigides. Le rayon des sphères est pris comme étant la valeur maximale telle que les atomes ne se chevauchent pas. En science des matériaux, le facteur de garnissage atomique d’une cellule unitaire explique de nombreuses propriétés des matériaux. Par exemple, les métaux avec un facteur de tassement atomique élevé auront une malléabilité ou une ductilité plus élevée, similaire à la façon dont une route est plus lisse lorsque les pierres sont plus proches les unes des autres, permettant aux atomes métalliques de glisser plus facilement les uns sur les autres.
Par exemple, dans un arrangement fcc, une cellule unitaire contient (8 atomes de coin × ⅛) + (6 atomes de face × ½) = 4 atomes. Cette structure, avec son parent hexagonal (hcp), a le garnissage le plus efficace (74%).
Structure des grains et limites des grains
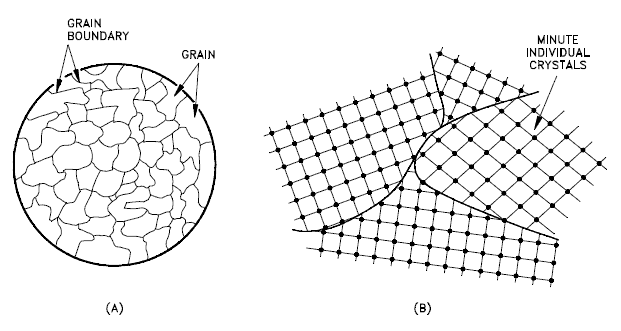
Tous les solides ne sont pas des monocristaux (par exemple, les semi- conducteurs de silicium). La plupart des solides cristallins sont composés d’un ensemble de nombreux petits cristaux ou grains de taille et d’orientation variables. Ceux-ci ont des orientations cristallographiques aléatoires. Lorsqu’un métal commence par cristalliser, le changement de phase commence par de petits cristaux qui se développent jusqu’à fusionner, formant une structure polycristalline. Dans le bloc final de matériau solide, chacun des petits cristaux (appelés « grains« ) est un vrai cristal avec un arrangement périodique d’atomes, mais l’ensemble du polycristal n’a pas d’arrangement périodique d’atomes, car le motif périodique est rompu à les joints de grains. Les grains et les joints de grains aident à déterminer les propriétés d’un matériau.
- Les grains, aussi appelés cristallites, sont des cristaux petits voire microscopiques qui se forment par exemple lors du refroidissement de nombreux matériaux (cristallisation). Une caractéristique très importante d’un métal est la taille moyenne du grain. La taille du grain détermine les propriétés du métal. Par exemple, une taille de grain plus petite augmente la résistance à la traction et tend à augmenter la ductilité. Une taille de grain plus grande est préférée pour améliorer les propriétés de fluage à haute température. Le fluage est la déformation permanente qui augmente avec le temps sous une charge ou une contrainte constante. Le fluage devient progressivement plus facile avec l’augmentation de la température.
- Limites de grains. La limite de grain fait référence à la zone extérieure d’un grain qui le sépare des autres grains. Les joints de grains séparent des régions cristallines diversement orientées (polycristallines) dans lesquelles les structures cristallines sont identiques. Les joints de grains sont des défauts 2D dans la structure cristalline et ont tendance à diminuer la conductivité électrique et thermique du matériau. La plupart des joints de grains sont des sites privilégiés pour l’apparition de la corrosion et pour la précipitation de nouvelles phases à partir du solide. Ils sont également importants pour de nombreux mécanismes de fluage. D’autre part, les joints de grains perturbent le mouvement des dislocations à travers un matériau. La propagation des dislocations est entravée en raison du champ de contraintes de la région du défaut aux joints de grains et du manque de plans et de directions de glissement et d’alignement global à travers les joints. Par conséquent, la réduction de la taille des cristallites est un moyen courant d’améliorer la résistance mécanique, car les grains plus petits créent plus d’obstacles par unité de surface du plan de glissement.
Orientation des grains
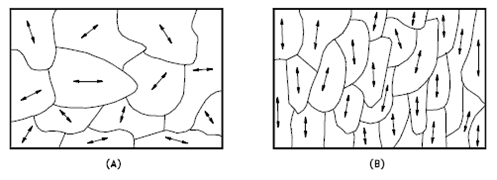
L’ orientation des cristallites peut être aléatoire sans direction préférée, appelée texture aléatoire, ou préférée, éventuellement en raison des conditions de croissance et de traitement. Une orientation aléatoire peut être obtenue par laminage croisé du matériau. Si un tel échantillon était suffisamment laminé dans une direction, il pourrait développer une structure à grains orientés dans la direction de laminage. C’est ce qu’on appelle l’orientation préférée. Dans de nombreux cas, l’orientation préférée est très souhaitable, mais dans d’autres cas, elle peut être très nocive. Par exemple, l’orientation préférée des éléments combustibles à l’uranium peut entraîner des changements catastrophiques de dimensions pendant l’utilisation dans un réacteur nucléaire.
Référence spéciale: US Department of Energy, Material Science. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
Polymorphisme et allotropie
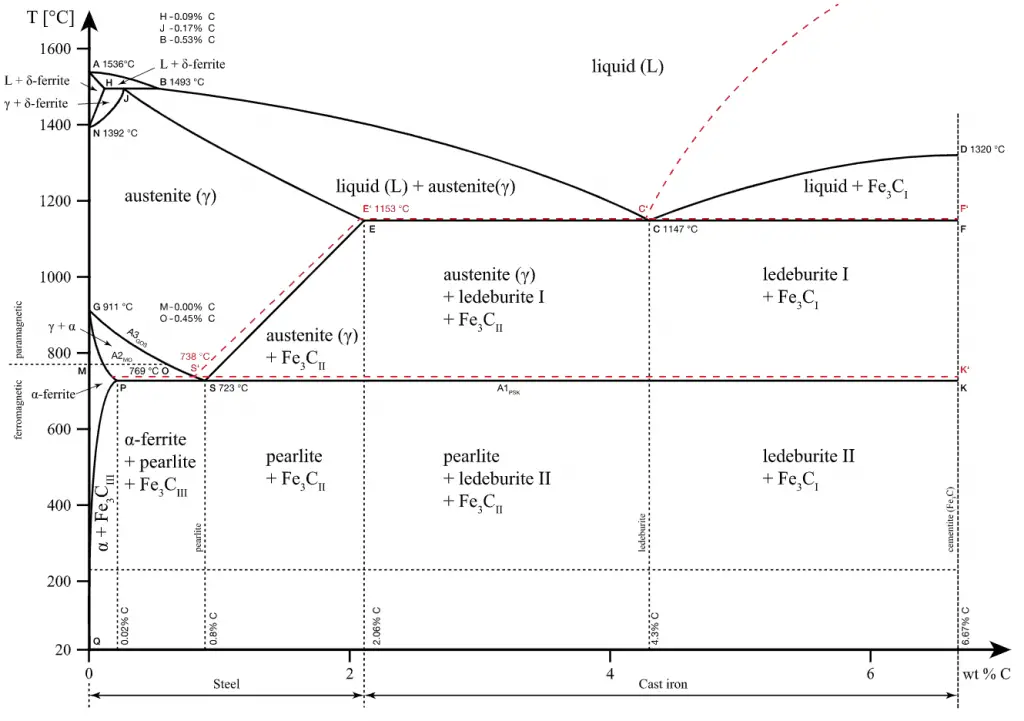
Certains matériaux cristallins peuvent avoir plus d’une structure cristalline , un phénomène connu sous le nom de polymorphisme . Le polymorphisme est l’apparition de plusieurs formes cristallines d’un matériau. Selon les règles d’équilibre des phases de Gibbs, ces phases cristallines uniques dépendent de variables intensives telles que la thermodynamics/thermodynamic-properties/what-is-pressure-physics/ »>pression et la température. Le polymorphisme est lié à l’ allotropie, qui fait référence aux éléments chimiques. Cela signifie que le polymorphisme est le terme le plus général utilisé pour tout matériau cristallin, y compris les alliages et les éléments chimiques. Chaque polymorphe est en fait un état solide thermodynamique différent et les polymorphes cristallins du même composé présentent des propriétés physiques différentes, telles que la vitesse de dissolution, la forme (angles entre les facettes et taux de croissance des facettes), le point de fusion, etc. Pour cette raison, le polymorphisme est de importance majeure dans la fabrication industrielle des produits cristallins.
Un exemple familier se trouve dans le carbone. Le graphite (un solide mou, noir et floconneux, un conducteur électrique modéré) est le polymorphe stable dans les conditions ambiantes, tandis que le diamant (un cristal extrêmement dur et transparent, avec les atomes de carbone disposés dans un réseau tétraédrique. Un mauvais conducteur électrique. Un excellent conducteur thermique.) se forme à des pressions extrêmement élevées.
De plus, le fer pur a une structure cristalline BCC à température ambiante, qui se transforme en fer FCC à 913 °C. Le zirconium est HCP (alpha) jusqu’à 863°C, où il se transforme en forme BCC (bêta, zirconium). Le problème est que ces transitions de phase rendent ce matériau très cassant.
Voir aussi: Oxydation à la vapeur à haute température des alliages de zirconium
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Crystal Structures, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.