Enlaces intermoleculares
Las fuerzas intermoleculares son las fuerzas que median la interacción entre moléculas, incluidas las fuerzas de atracción o repulsión que actúan entre moléculas y otros tipos de partículas vecinas. Las fuerzas intermoleculares atractivas y sus enlaces resultantes se clasifican en los siguientes tipos:
- Enlace molecular. Cuando los electrones de los átomos neutros pasan más tiempo en una región de su órbita, existirá una carga débil temporal. La molécula atraerá débilmente a otras moléculas. Esto a veces se denomina enlaces de van der Waals o moleculares.
- Enlace de hidrógeno. Un enlace de hidrógeno puede ser intermolecular (que ocurre entre moléculas separadas) o intramolecular (que ocurre entre partes de la misma molécula). El enlace de hidrógeno es una fuerza de atracción principalmente electrostática entre un átomo de hidrógeno (H) que está unido covalentemente a un átomo o grupo más electronegativo.
Enlace de hidrógeno
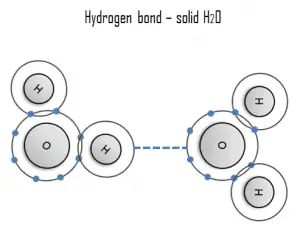 Un enlace de hidrógeno puede ser intermolecular (que ocurre entre moléculas separadas) o intramolecular (que ocurre entre partes de la misma molécula). El enlace de hidrógeno es una fuerza de atracción principalmente electrostática entre un átomo de hidrógeno (H) que está unido covalentemente a un átomo o grupo más electronegativo.
Un enlace de hidrógeno puede ser intermolecular (que ocurre entre moléculas separadas) o intramolecular (que ocurre entre partes de la misma molécula). El enlace de hidrógeno es una fuerza de atracción principalmente electrostática entre un átomo de hidrógeno (H) que está unido covalentemente a un átomo o grupo más electronegativo.
Un hidrógeno es un claro ejemplo de interacción entre dos dipolos permanentes. La gran diferencia de electronegatividades entre el hidrógeno y el flúor , el nitrógeno y el oxígeno , junto con sus pares de electrones solitarios, provocan fuertes fuerzas electrostáticas entre las moléculas. Un ejemplo omnipresente de un enlace de hidrógeno se encuentra entre las moléculas de agua. Los enlaces de hidrógeno son responsables de los altos puntos de ebullición del agua. Cada molécula de H 2 O tiene dos átomos de hidrógeno que pueden unirse a los átomos de oxígeno. Además, su único átomo de O puede unirse a dos átomos de hidrógeno de otros H 2O moléculas. Por lo tanto, para el hielo sólido, cada molécula de agua participa en cuatro enlaces de hidrógeno, lo que ayuda a crear una red hexagonal abierta. El alto punto de ebullición del agua líquida se debe al alto número de enlaces de hidrógeno que puede formar cada molécula, en relación con su baja masa molecular. Debido a la dificultad de romper estos enlaces, el agua tiene un punto de ebullición, un punto de fusión y una viscosidad muy altos en comparación con otros líquidos similares no unidos por enlaces de hidrógeno.
[/ lgc_column]
Ciencia de los materiales:
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
[/ su_spoiler] [/ su_accordion]
[/ lgc_column]Véase más arriba:
Enlace químico [/ su_button] [/ lgc_column]
Esperamos que este artículo, Enlaces intermoleculares , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.