Enlaces intramoleculares
Un enlace intramolecular es cualquier enlace que une los átomos que forman una molécula o compuesto. El modelo clásico identifica tres tipos principales de enlaces químicos: iónicos, covalentes y metálicos.
- Enlace iónico . Un enlace iónico es un enlace químico, en el que uno o más electrones se transfieren por completo de un átomo de un elemento al átomo del otro, y los elementos se mantienen unidos por la fuerza de atracción debida a la polaridad opuesta de la carga. Este tipo de enlace químico es típico entre elementos con una gran diferencia de electronegatividad.
- Enlace covalente . Un enlace covalente es un enlace químico formado por electrones compartidos. Los electrones de valencia se comparten cuando un átomo necesita electrones para completar su capa exterior y puede compartir esos electrones con su vecino. Los electrones son entonces parte de ambos átomos y ambas capas se llenan.
- Enlace metálico . Un enlace metálico es un enlace químico, en el que los átomos no comparten ni intercambian electrones para unirse. En cambio, muchos electrones (aproximadamente uno por cada átomo) son más o menos libres para moverse por el metal, de modo que cada electrón puede interactuar con muchos de los átomos fijos.
Enlace iónico
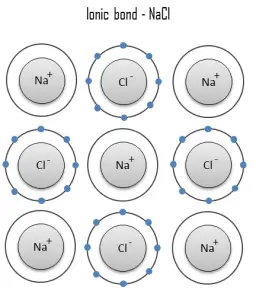 Un enlace iónico es un enlace químico, en el que uno o más electrones se transfieren por completo de un átomo de un elemento al átomo del otro, y los elementos se mantienen unidos por la fuerza de atracción debida a la polaridad opuesta de la carga. Este tipo de enlace químico es típico entre elementos con una gran diferencia de electronegatividad (es decir, elementos situados en los extremos horizontales de la tabla periódica ). Un enlace iónico siempre se encuentra en compuestos compuestos por elementos metálicos y no metálicos. No existe un valor preciso que distinga los enlaces iónicos de los covalentes, pero es probable que una diferencia de electronegatividad de más de 1,7 sea iónica, mientras que una diferencia de menos de 1,7 sea covalente.
Un enlace iónico es un enlace químico, en el que uno o más electrones se transfieren por completo de un átomo de un elemento al átomo del otro, y los elementos se mantienen unidos por la fuerza de atracción debida a la polaridad opuesta de la carga. Este tipo de enlace químico es típico entre elementos con una gran diferencia de electronegatividad (es decir, elementos situados en los extremos horizontales de la tabla periódica ). Un enlace iónico siempre se encuentra en compuestos compuestos por elementos metálicos y no metálicos. No existe un valor preciso que distinga los enlaces iónicos de los covalentes, pero es probable que una diferencia de electronegatividad de más de 1,7 sea iónica, mientras que una diferencia de menos de 1,7 sea covalente.
La unión iónica conduce a la separación de iones positivos y negativos. En el proceso, todos los átomos adquieren configuraciones de gas estable o inerte (es decir, capas orbitales completamente llenas) y, además, una carga eléctrica, es decir, se convierten en iones. Por ejemplo, la sal de mesa común es el cloruro de sodio. El cloruro de sodio (NaCl) es el material iónico clásico. Un átomo de sodio puede asumir la estructura electrónica del neón mediante la transferencia de su único electrón de valencia 3s a un átomo de cloro. Después de tal transferencia, el ion cloro adquiere una carga neta negativa, una configuración electrónica idéntica a la del argón; también es más grande que el átomo de cloro. Estos iones luego se atraen entre sí en una proporción de 1: 1 para formar cloruro de sodio (NaCl).
Na + Cl → Na + + Cl - → NaCl
Los compuestos iónicos conducen la electricidad cuando están fundidos o en solución, generalmente como un sólido. Los compuestos iónicos generalmente tienen un alto punto de fusión , dependiendo de la carga de los iones que los componen. Cuanto mayores sean las cargas, más fuertes serán las fuerzas cohesivas y mayor será el punto de fusión. También tienden a ser solubles en agua; cuanto más fuertes sean las fuerzas cohesivas, menor será la solubilidad.
Enlace covalente
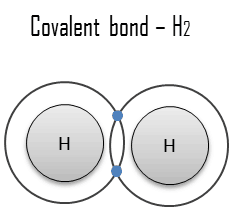 Un enlace covalente es un enlace químico formado por electrones compartidos . Los electrones de valencia se comparten cuando un átomo necesita electrones para completar su capa exterior y puede compartir esos electrones con su vecino. Los electrones son entonces parte de ambos átomos y ambas capas se llenan. Estos pares de electrones se conocen como pares compartidos o pares de enlace , y el equilibrio estable de fuerzas atractivas y repulsivas entre átomos, cuando comparten electrones, se conoce como enlace covalente .
Un enlace covalente es un enlace químico formado por electrones compartidos . Los electrones de valencia se comparten cuando un átomo necesita electrones para completar su capa exterior y puede compartir esos electrones con su vecino. Los electrones son entonces parte de ambos átomos y ambas capas se llenan. Estos pares de electrones se conocen como pares compartidos o pares de enlace , y el equilibrio estable de fuerzas atractivas y repulsivas entre átomos, cuando comparten electrones, se conoce como enlace covalente .
El tipo más simple y común es un enlace sencillo en el que dos átomos comparten dos electrones. Otros tipos incluyen el enlace doble (por ejemplo, H 2 C = CH 2 ), el enlace triple, enlaces de uno y tres electrones, enlace de dos electrones de tres centros y enlace de cuatro electrones de tres centros.
La covalencia es máxima entre átomos de electronegatividades similares . Por lo tanto, el enlace covalente no requiere necesariamente que los dos átomos sean de los mismos elementos, solo que tengan una electronegatividad comparable (es decir, elementos que se encuentran cerca uno del otro en la tabla periódica ). No existe un valor preciso que distinga los enlaces iónicos de los covalentes, pero es probable que una diferencia de electronegatividad de más de 1,7 sea iónica, mientras que una diferencia de menos de 1,7 sea covalente.
Enlace metálico
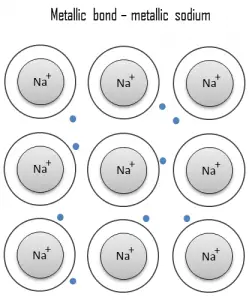 Un enlace metálico es un enlace químico, en el que los átomos no comparten ni intercambian electrones para unirse. En cambio, muchos electrones (aproximadamente uno por cada átomo) son más o menos libres para moverse por el metal, de modo que cada electrón puede interactuar con muchos de los átomos fijos. Los electrones libres protegen los núcleos de iones cargados positivamente de las fuerzas electrostáticas mutuamente repulsivas que de otro modo se ejercerían entre sí; en consecuencia, el enlace metálico es de carácter no direccional. La unión metálica se encuentra en metales y sus aleaciones. El libre movimiento o deslocalización de los electrones enlazados conduce a propiedades metálicas clásicas como el brillo (reflectividad de la luz superficial), conductividad eléctrica y térmica , ductilidad y alta resistencia a la tracción.
Un enlace metálico es un enlace químico, en el que los átomos no comparten ni intercambian electrones para unirse. En cambio, muchos electrones (aproximadamente uno por cada átomo) son más o menos libres para moverse por el metal, de modo que cada electrón puede interactuar con muchos de los átomos fijos. Los electrones libres protegen los núcleos de iones cargados positivamente de las fuerzas electrostáticas mutuamente repulsivas que de otro modo se ejercerían entre sí; en consecuencia, el enlace metálico es de carácter no direccional. La unión metálica se encuentra en metales y sus aleaciones. El libre movimiento o deslocalización de los electrones enlazados conduce a propiedades metálicas clásicas como el brillo (reflectividad de la luz superficial), conductividad eléctrica y térmica , ductilidad y alta resistencia a la tracción.
El metal es un material (generalmente sólido) que comprende uno o más elementos metálicos (p. Ej., Hierro, aluminio, cobre, cromo, titanio, oro, níquel) y, a menudo, también elementos no metálicos (p. Ej., Carbono, nitrógeno, oxígeno) en cantidades relativamente pequeñas. . La característica única de los metales en lo que respecta a su estructura es la presencia de portadores de carga, específicamente electrones . Esta característica viene dada por la naturaleza del enlace metálico. Las conductividades eléctricas y térmicas de los metales se originan por el hecho de que sus electrones externos están deslocalizados .
[/ lgc_column]
Ciencia de los materiales:
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
[/ su_spoiler] [/ su_accordion]
[/ lgc_column]Véase más arriba:
Enlace químico [/ su_button] [/ lgc_column]
Esperamos que este artículo, Vínculos intramoleculares , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.