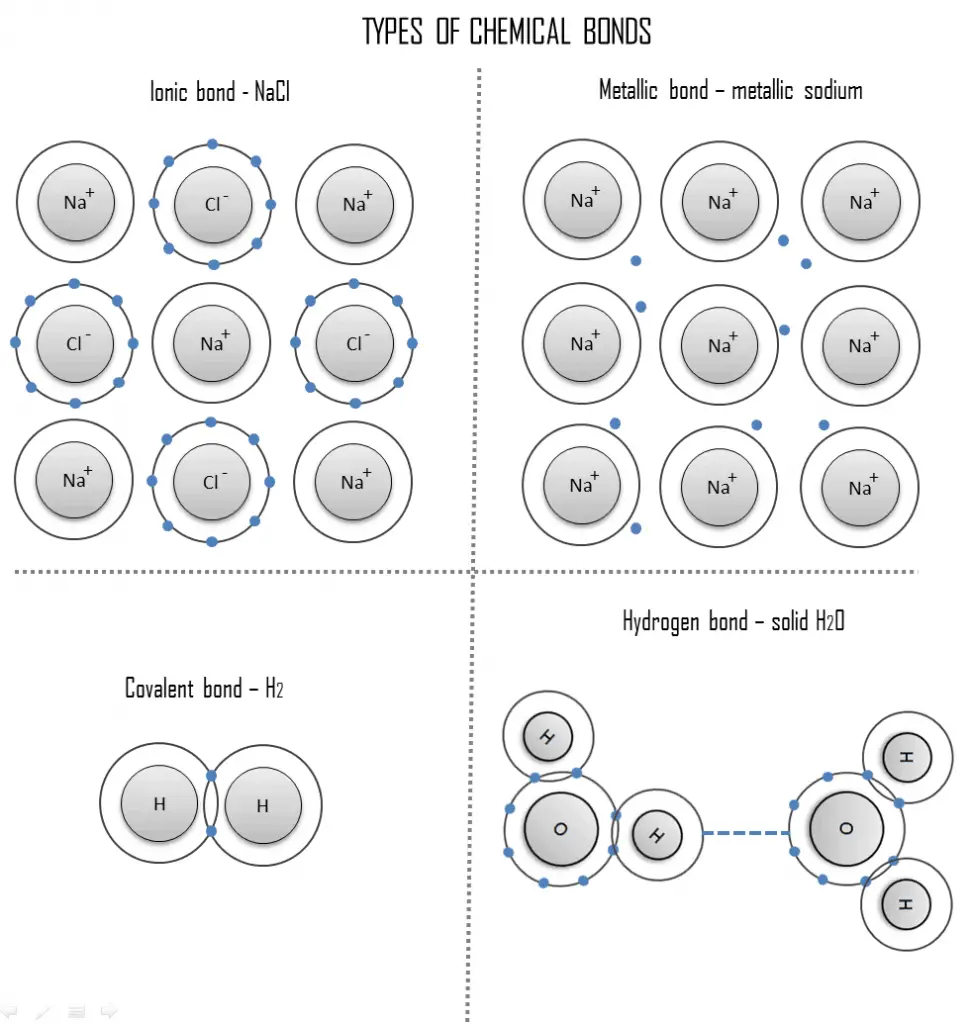
Une liaison chimique est une attraction durable entre ces atomes, ions ou molécules qui permet la formation de composés chimiques. La liaison peut résulter de la force électrostatique d’attraction entre des ions chargés de manière opposée comme dans les liaisons ioniques ou par le partage d’électrons comme dans les liaisons covalentes. Par conséquent, la force électromagnétique joue un rôle majeur dans la détermination des propriétés internes de la plupart des objets rencontrés dans la vie quotidienne.
La force des liaisons chimiques varie considérablement; il existe des « liaisons primaires » ou « liaisons fortes » telles que les liaisons ioniques, covalentes et métalliques, et des « liaisons faibles » ou « liaisons secondaires » telles que les interactions dipôle-dipôle, la force de dispersion de Londres et la liaison hydrogène. Dans ce chapitre, nous traiterons principalement des solides car les solides sont les plus préoccupants dans les applications d’ingénierie des matériaux. Les liquides et les gaz ne seront mentionnés qu’à des fins de comparaison. Les molécules des solides sont étroitement liées les unes aux autres. Lorsque les attractions sont plus faibles, la substance peut être sous forme liquide et libre de s’écouler. Les gaz ne présentent pratiquement aucune force d’attraction entre les atomes ou les molécules, et leurs particules sont libres de se déplacer indépendamment les unes des autres.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Obligations fortes primaires – Obligations faibles secondaires, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.