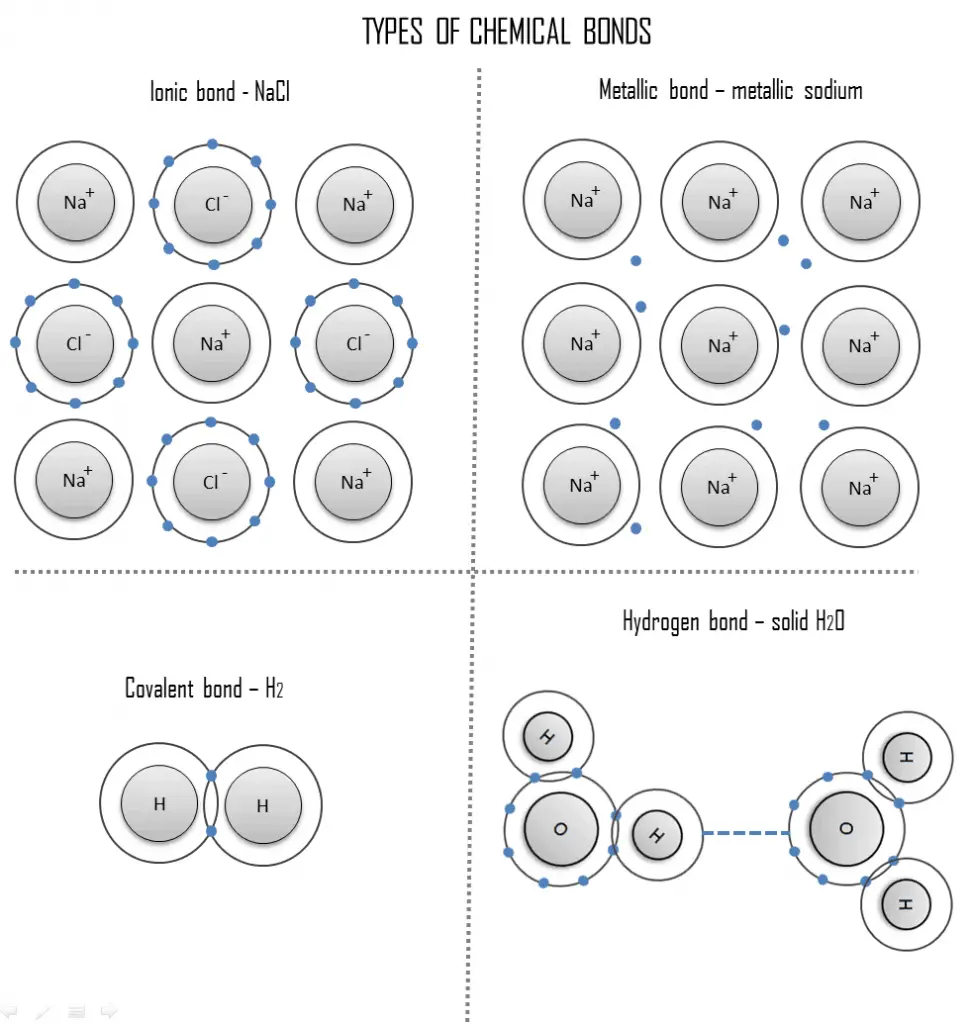
Trois types différents de liaison primaire ou chimique se trouvent dans les solides:
Liaisons intramoléculaires
- Liaison ionique. Une liaison ionique est une liaison chimique, dans laquelle un ou plusieurs électrons sont entièrement transférés d’un atome d’un élément à l’atome de l’autre, et les éléments sont maintenus ensemble par la force d’attraction due à la polarité opposée de la charge. Ce type de liaison chimique est typique entre les éléments avec une grande différence d’électronégativité.
- Liaison covalente. Une liaison covalente est une liaison chimique formée par des électrons partagés. Les électrons de Valence sont partagés lorsqu’un atome a besoin d’électrons pour compléter sa coque externe et peut partager ces électrons avec son voisin. Les électrons font alors partie des deux atomes et les deux coquilles sont remplies.
- Liaison métallique. Une liaison métallique est une liaison chimique, dans laquelle les atomes ne partagent pas ou n’échangent pas d’électrons pour se lier. Au lieu de cela, de nombreux électrons (environ un pour chaque atome) sont plus ou moins libres de se déplacer dans le métal, de sorte que chaque électron peut interagir avec de nombreux atomes fixes.
Liaisons intermoléculaires
- Liaison moléculaire. Lorsque les électrons des atomes neutres passent plus de temps dans une région de leur orbite, une faible charge temporaire existera. La molécule attirera faiblement d’autres molécules. Ceci est parfois appelé van der Waals ou liaisons moléculaires.
- Liaison hydrogène. Une liaison hydrogène peut être intermoléculaire (se produisant entre des molécules distinctes) ou intramoléculaire (se produisant entre des parties de la même molécule). La liaison hydrogène est une force d’attraction principalement électrostatique entre un atome d’hydrogène (H) qui est lié de manière covalente à un atome ou un groupe plus électronégatif.
La force des liaisons chimiques varie considérablement; il existe des « liaisons primaires » ou « liaisons fortes » telles que les liaisons ioniques, covalentes et métalliques, et des « liaisons faibles » ou « liaisons secondaires » telles que les interactions dipôle-dipôle, la force de dispersion de Londres et la liaison hydrogène. Dans ce chapitre, nous traiterons principalement des solides car les solides sont les plus préoccupants dans les applications d’ingénierie des matériaux. Les liquides et les gaz ne seront mentionnés qu’à des fins de comparaison. Les molécules des solides sont étroitement liées les unes aux autres. Lorsque les attractions sont plus faibles, la substance peut être sous forme liquide et libre de s’écouler. Les gaz ne présentent pratiquement aucune force d’attraction entre les atomes ou les molécules, et leurs particules sont libres de se déplacer indépendamment les unes des autres.
Le type de liaison détermine non seulement la façon dont un matériau est maintenu ensemble, mais détermine également les propriétés microscopiques que possède le matériau. Des propriétés telles que la capacité à conduire la chaleur ou le courant électrique sont déterminées par la liberté de mouvement des électrons. Cela dépend du type de liaison présente. La connaissance de la structure microscopique d’un matériau nous permet de prédire comment ce matériau se comportera dans certaines conditions.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Types de liaisons chimiques, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.