 A corrosão é a deterioração de um material devido à interação química com o meio ambiente. É um processo natural no qual os metais convertem sua estrutura em uma forma quimicamente mais estável, como óxidos, hidróxidos ou sulfetos. As consequências da corrosão são muito comuns. Exemplos familiares incluem a ferrugem de painéis e tubulações de carrocerias automotivas e muitas ferramentas. A corrosão costuma ser um fenômeno negativo, pois está associada à falha mecânica de um objeto. Átomos de metal são removidos de um elemento estrutural até que ele falhe, ou óxidos se acumulam dentro de um tubo até que seja entupido. Todos os metais e ligas estão sujeitos à corrosão. Mesmo os metais nobres, como o ouro, estão sujeitos ao ataque corrosivo em alguns ambientes.
A corrosão é a deterioração de um material devido à interação química com o meio ambiente. É um processo natural no qual os metais convertem sua estrutura em uma forma quimicamente mais estável, como óxidos, hidróxidos ou sulfetos. As consequências da corrosão são muito comuns. Exemplos familiares incluem a ferrugem de painéis e tubulações de carrocerias automotivas e muitas ferramentas. A corrosão costuma ser um fenômeno negativo, pois está associada à falha mecânica de um objeto. Átomos de metal são removidos de um elemento estrutural até que ele falhe, ou óxidos se acumulam dentro de um tubo até que seja entupido. Todos os metais e ligas estão sujeitos à corrosão. Mesmo os metais nobres, como o ouro, estão sujeitos ao ataque corrosivo em alguns ambientes.
A maioria dos metais não é termodinamicamente estável na forma metálica; eles querem corroer e reverter para as formas mais estáveis que normalmente são encontradas em minérios, como óxidos. A corrosão também pode ocorrer em outros materiais que não os metais, como cerâmicas ou polímeros, embora neste contexto o termo “degradação” seja mais comum. Os materiais cerâmicos são relativamente resistentes à deterioração, que geralmente ocorre em temperaturas elevadas ou em ambientes bastante extremos. O processo é freqüentemente também chamado de corrosão. Para polímeros, os mecanismos e consequências diferem daqueles para metais e cerâmicas, e o termo degradação é usado com mais frequência. A corrosão degrada as propriedades úteis de materiais e estruturas, incluindo resistência, aparência e permeabilidade a líquidos e gases.
A corrosão é de natureza eletroquímica porque as reações químicas corrosivas envolvem uma transferência de carga. A química da corrosão é bastante complexa, mas pode ser considerada essencialmente como um fenômeno eletroquímico. Os íons metálicos entram em solução fazendo com que o metal fique carregado negativamente em relação ao eletrólito. A diferença na carga causa o desenvolvimento de um potencial e produz uma voltagem entre o eletrólito e o metal.
A corrosão, como um processo natural e persistente, também envolve a deterioração não intencional de metais, às vezes com resultados desastrosos. Qual é o tamanho do problema de corrosão? O problema da corrosão metálica é significativo. Em termos econômicos, estima-se que aproximadamente 5% da renda de uma nação industrializada é gasta na prevenção da corrosão e na manutenção ou substituição de produtos perdidos ou contaminados como resultado de reações de corrosão.
A corrosão é a principal preocupação em usinas de reatores nucleares. A corrosão ocorre continuamente em toda a planta do reator e todo metal está sujeito a ela. Embora essa corrosão não possa ser eliminada, ela pode ser controlada.
Proteção contra corrosão
Como foi escrito, o problema da corrosão metálica é significativo. Em termos econômicos, estima-se que aproximadamente 5% da renda de uma nação industrializada é gasta na prevenção da corrosão e na manutenção ou substituição de produtos perdidos ou contaminados como resultado de reações de corrosão. Portanto, vários tratamentos são usados para retardar os danos por corrosão em objetos metálicos expostos ao clima, água salgada, ácidos ou outros ambientes hostis. Uma vez que existem muitas formas de corrosão, existem muitas maneiras de parar ou mitigar a corrosão. Em todos os casos, depende do material a ser protegido e também do ambiente em que o material é utilizado. Os metais podem ser protegidos da corrosão usando um metal em um ambiente ao qual ele é imune, fazendo uma barreira física entre o metal e seu ambiente,
- Seleção de Materiais. Talvez a maneira mais comum e fácil de prevenir a corrosão seja através da seleção criteriosa de materiais, uma vez que o ambiente de corrosão tenha sido caracterizado. Alguns metais ferrosos e muitos não ferrosos e ligas são amplamente utilizados em ambientes corrosivos. Em todos os casos, depende fortemente de determinado ambiente e outras condições. Aqui, o custo pode ser um fator significativo. Nem sempre é economicamente viável empregar o material que oferece a melhor resistência à corrosão.
- Tratamento Superficial Anticorrosivo. Um revestimento fornece proteção formando uma barreira física entre o substrato metálico e um ambiente corrosivo aquoso. Os revestimentos protegem as estruturas metálicas da corrosão por efeitos de inibição e barreira. O efeito de barreira depende da adesão à subcamada, mas também das propriedades não condutoras do revestimento. A penetração de água ou íons é uma das principais causas de perda da barreira, o que pode levar à delaminação do revestimento e corrosão sob o filme. Revestimento, pintura e aplicação de esmalte são os tratamentos anticorrosivos mais comuns.
- Anodização. A anodização é um processo de passivação eletrolítica usado para aumentar a espessura da camada de óxido natural na superfície das peças metálicas. Um número limitado de metais, como aços inoxidáveis, pode atingir a passividade. O processo é chamado de anodização porque a peça a ser tratada forma o eletrodo anódico de uma célula eletrolítica. As ligas de alumínio são geralmente anodizadas para aumentar a resistência à corrosão e permitir o tingimento (coloração).
- Proteção catódica. A proteção catódica é uma forma muito eficaz de proteção contra a corrosão baseada no uso de um material mais anódico que o metal a ser protegido. O metal protegido é conectado eletricamente a outro metal que é mais reativo no ambiente específico. O metal menos resistente à corrosão torna-se ânodo e o metal com maior resistência à corrosão torna-se cátodo. A corrosão da resistência menos corrosiva geralmente é aumentada e o ataque em material mais resistente é diminuído. Existe uma diferença no potencial elétrico entre os diferentes metais e serve como força motriz para o fluxo de corrente elétrica através do corrosivo ou eletrólito. Os sistemas de proteção catódica são mais comumente usados para proteger estruturas metálicas enterradas ou submersas da corrosão, como tubulações e tanques de aço. magnésio, zinco, e ligas de alumínio são ânodos de sacrifício comuns. Ânodos de magnésio são mais comumente usados para aplicações de solo enterrado. O zinco é mais frequentemente usado para aplicações marinhas de água doce e salgada. As ligas de alumínio são mais frequentemente usadas para estruturas offshore.
- Inibidores de Corrosão. Se o ambiente for controlado (especialmente em sistemas de recirculação), frequentemente podem ser adicionados inibidores de corrosão. Esses produtos químicos formam um revestimento eletricamente isolante ou quimicamente impermeável em superfícies metálicas expostas, para suprimir reações eletroquímicas. Os inibidores de corrosão são produtos químicos que, quando adicionados ao meio ambiente em concentrações relativamente baixas, reduzem a taxa de um processo corrosivo. Qual substância que age como inibidor depende tanto do ambiente corrosivo quanto da liga. Os inibidores são normalmente usados em sistemas fechados, como radiadores de automóveis e caldeiras de vapor. Um exemplo desse princípio é o uso de anticongelante em carros. A eficácia de um inibidor depende de vários mecanismos diferentes. Alguns reagem com as espécies quimicamente ativas na solução, enquanto outros reagem com a superfície corrosiva e interferem na reação corrosiva ou formam uma fina camada protetora. Por exemplo, o oxigênio é geralmente removido por inibidores redutores, como aminas e hidrazinas. Neste exemplo, a hidrazina converte oxigênio, um agente corrosivo comum, em água, que geralmente é benigna. Muitos inibidores também são tóxicos e, portanto, não são adequados para uso em todas as aplicações. Outra limitação dos inibidores é que eles geralmente perdem a eficácia quando a temperatura e a concentração do ambiente aumentam. um agente corrosivo comum, à água, que geralmente é benigna. Muitos inibidores também são tóxicos e, portanto, não são adequados para uso em todas as aplicações. Outra limitação dos inibidores é que eles geralmente perdem a eficácia quando a temperatura e a concentração do ambiente aumentam. um agente corrosivo comum, à água, que geralmente é benigna. Muitos inibidores também são tóxicos e, portanto, não são adequados para uso em todas as aplicações. Outra limitação dos inibidores é que eles geralmente perdem a eficácia quando a temperatura e a concentração do ambiente aumentam.
Ligas resistentes à corrosão
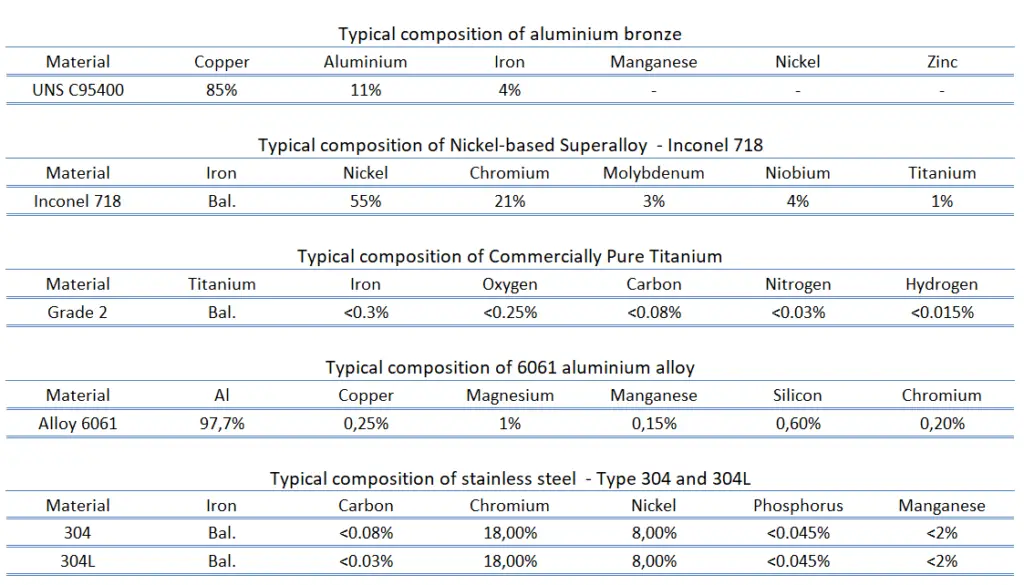
As ligas resistentes à corrosão, como o próprio nome indica, são ligas com maior resistência à corrosão. Alguns metais ferrosos e muitos não ferrosos e ligas são amplamente utilizados em ambientes corrosivos. Em todos os casos, depende fortemente de determinado ambiente e outras condições. Ligas resistentes à corrosão são usadas para tubulações de água e muitas aplicações químicas e industriais. No caso de ligas ferrosas, estamos falando de aços inoxidáveis e, até certo ponto, de ferros fundidos. Mas algumas ligas não ferrosas resistentes à corrosão exibem notável resistência à corrosão e, portanto, podem ser usadas para muitos propósitos especiais. Existem duas razões principais pelas quais os materiais não ferrosos são preferidos aos aços e aços inoxidáveis para muitas dessas aplicações. Por exemplo, muitos dos os metais não ferrosos e as ligas possuem uma resistência muito maior à corrosão do que os aços-liga disponíveis e os tipos de aço inoxidável. Em segundo lugar, uma alta relação resistência/peso ou alta condutividade térmica e elétrica pode fornecer uma vantagem distinta sobre uma liga ferrosa.
Passivação
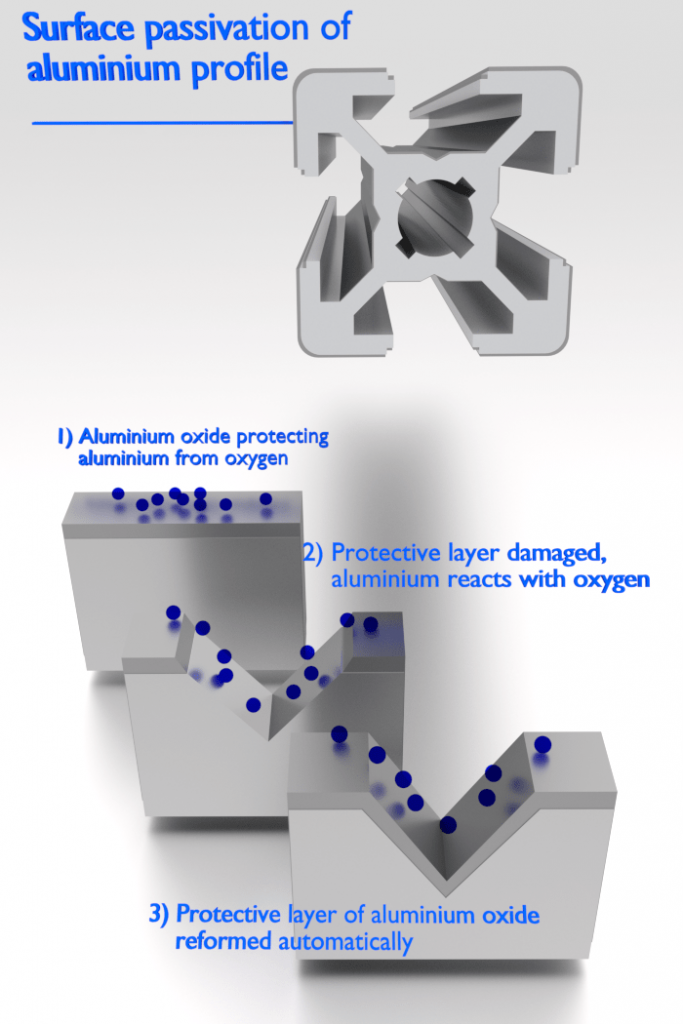 Existem metais, que apresentam uma passividade à corrosão. A passividade é a característica de um metal exibida quando esse metal não se torna ativo na reação de corrosão. A passivação é um processo natural de formação de uma camada estável e tenaz de óxido metálico ou barreira protetora na superfície do metal que atua como uma barreira separando a superfície do metal do meio ambiente. A passividade diminui ou interrompe o processo de corrosão devido à formação da camada. Felizmente, do ponto de vista da engenharia, os metais mais suscetíveis a esse tipo de comportamento são os materiais estruturais e de engenharia comuns, incluindo ferro, níquel, silício, cromo, titânio e ligas contendo esses metais.
Existem metais, que apresentam uma passividade à corrosão. A passividade é a característica de um metal exibida quando esse metal não se torna ativo na reação de corrosão. A passivação é um processo natural de formação de uma camada estável e tenaz de óxido metálico ou barreira protetora na superfície do metal que atua como uma barreira separando a superfície do metal do meio ambiente. A passividade diminui ou interrompe o processo de corrosão devido à formação da camada. Felizmente, do ponto de vista da engenharia, os metais mais suscetíveis a esse tipo de comportamento são os materiais estruturais e de engenharia comuns, incluindo ferro, níquel, silício, cromo, titânio e ligas contendo esses metais.
Por exemplo, o aço inoxidável deve suas propriedades de resistência à corrosão à formação de um filme superficial passivo auto-reparador. Para que a passivação ocorra e permaneça estável, a liga Fe-Cr deve ter um teor mínimo de cromo de cerca de 10,5% em peso, acima do qual a passividade pode ocorrer e abaixo do qual é impossível. Uma vez que a superfície é limpa e a composição a granel do aço inoxidável é exposta ao ar, o filme passivo se forma imediatamente.
O alumínio é altamente resistente à corrosão em muitos ambientes porque também passiva. Se danificada, a película protetora normalmente se reconstitui muito rapidamente. No entanto, uma mudança no caráter do ambiente (por exemplo, alteração na concentração das espécies corrosivas ativas) pode fazer com que um material passivado volte a um estado ativo. Geralmente, em altas temperaturas (na água, a corrosão limita o uso do alumínio a temperaturas próximas a 100°C), a relativa baixa resistência e as fracas propriedades de corrosão do alumínio o tornam inadequado como material estrutural.
Ciência de materiais:
- Departamento de Energia dos EUA, Ciência de Materiais. DOE Fundamentals Handbook, Volume 1 e 2. Janeiro de 1993.
- Departamento de Energia dos EUA, Ciência de Materiais. DOE Fundamentals Handbook, Volume 2 e 2. Janeiro de 1993.
- William D. Callister, David G. Rethwisch. Ciência e Engenharia de Materiais: Uma Introdução 9ª Edição, Wiley; 9 edição (4 de dezembro de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por que as coisas quebram: entendendo o mundo pela maneira como ele se desfaz. Harmonia. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introdução à Termodinâmica dos Materiais (4ª ed.). Editora Taylor e Francis. ISBN 978-1-56032-992-3.
- González-Viñas, W. & Mancini, HL (2004). Uma Introdução à Ciência dos Materiais. Princeton University Press. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiais: engenharia, ciência, processamento e design (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introdução à Engenharia Nuclear, 3ª ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
Esperamos que este artigo, Proteção contra corrosão, o ajude. Se sim, dê um like na barra lateral. O objetivo principal deste site é ajudar o público a aprender algumas informações interessantes e importantes sobre materiais e suas propriedades.