 La corrosión es el deterioro de un material debido a la interacción química con su entorno. Es un proceso natural en el que los metales convierten su estructura en una forma más estable químicamente, como óxidos, hidróxidos o sulfuros. Las consecuencias de la corrosión son demasiado comunes. Los ejemplos familiares incluyen la oxidación de paneles y tuberías de la carrocería de automóviles y muchas herramientas. La corrosión suele ser un fenómeno negativo, ya que está asociado con la falla mecánica de un objeto. Los átomos de metal se eliminan de un elemento estructural hasta que falla, o los óxidos se acumulan dentro de una tubería hasta que se tapa. Todos los metales y aleaciones están sujetos a corrosión. Incluso los metales nobles, como el oro, están sujetos a un ataque corrosivo en algunos entornos.
La corrosión es el deterioro de un material debido a la interacción química con su entorno. Es un proceso natural en el que los metales convierten su estructura en una forma más estable químicamente, como óxidos, hidróxidos o sulfuros. Las consecuencias de la corrosión son demasiado comunes. Los ejemplos familiares incluyen la oxidación de paneles y tuberías de la carrocería de automóviles y muchas herramientas. La corrosión suele ser un fenómeno negativo, ya que está asociado con la falla mecánica de un objeto. Los átomos de metal se eliminan de un elemento estructural hasta que falla, o los óxidos se acumulan dentro de una tubería hasta que se tapa. Todos los metales y aleaciones están sujetos a corrosión. Incluso los metales nobles, como el oro, están sujetos a un ataque corrosivo en algunos entornos.
La mayoría de los metales no son termodinámicamente estables en forma metálica; quieren corroerse y volver a las formas más estables que se encuentran normalmente en los minerales, como los óxidos. La corrosión también puede ocurrir en materiales distintos de los metales, como cerámicas o polímeros, aunque en este contexto, el término «degradación» es más común. Los materiales cerámicos son relativamente resistentes al deterioro, que suele ocurrir a temperaturas elevadas o en entornos bastante extremos. Con frecuencia, el proceso también se denomina corrosión. En el caso de los polímeros, los mecanismos y las consecuencias difieren de los de los metales y las cerámicas, y el término degradación se utiliza con mayor frecuencia. La corrosión degrada las propiedades útiles de los materiales y estructuras, incluida la resistencia, apariencia y permeabilidad a líquidos y gases.
La corrosión es de naturaleza electroquímica porque las reacciones químicas corrosivas implican una transferencia de carga. La química de la corrosión es bastante compleja, pero puede considerarse esencialmente como un fenómeno electroquímico. Los iones metálicos se disuelven haciendo que el metal se cargue negativamente con respecto al electrolito. La diferencia en la carga hace que se desarrolle un potencial y produce un voltaje entre el electrolito y el metal.
La corrosión , como proceso natural y persistente, también implica el deterioro involuntario de los metales, a veces con resultados desastrosos. ¿Qué tan grande es el problema de la corrosión? El problema de la corrosión metálica es significativo. En términos económicos , se ha estimado que aproximadamente el 5% de los ingresos de una nación industrializada se gasta en la prevención de la corrosión y el mantenimiento o reemplazo de productos perdidos o contaminados como resultado de reacciones de corrosión.
La corrosión es la principal preocupación en las plantas de reactores nucleares. La corrosión se produce continuamente en toda la planta del reactor y todos los metales están sujetos a ella. Aunque esta corrosión no se puede eliminar, se puede controlar.
Protección contra la corrosión
Como se escribió, el problema de la corrosión metálica es significativo. En términos económicos, se ha estimado que aproximadamente el 5% de los ingresos de una nación industrializada se gasta en la prevención de la corrosión y el mantenimiento o reemplazo de productos perdidos o contaminados como resultado de reacciones de corrosión. Por lo tanto, se utilizan varios tratamientos para retardar el daño por corrosión de los objetos metálicos que están expuestos a la intemperie, agua salada, ácidos u otros entornos hostiles. Dado que existen muchas formas de corrosión, existen muchas formas de detener o mitigar la corrosión. En todos los casos, depende del material a proteger y también del entorno en el que se utiliza el material. Los metales pueden protegerse de la corrosión utilizando un metal en un entorno en el que sea inmune, creando una barrera física entre el metal y su entorno.
- Selección de material . Quizás la forma más común y fácil de prevenir la corrosión es mediante la selección juiciosa de materiales una vez que se ha caracterizado el entorno de corrosión. Algunos metales y aleaciones ferrosos y muchos no ferrosos se utilizan ampliamente en entornos corrosivos. En todos los casos, depende en gran medida de cierto entorno y otras condiciones. Aquí, el costo puede ser un factor importante. No siempre es económicamente viable emplear el material que proporcione la resistencia óptima a la corrosión.
- Tratamiento superficial anticorrosión . Un recubrimiento proporciona protección al formar una barrera física entre el sustrato metálico y un ambiente corrosivo acuoso. Los recubrimientos protegen las estructuras metálicas de la corrosión mediante efectos de inhibición y barrera. El efecto barrera depende de la adhesión a la capa inferior, pero también de las propiedades no conductoras del revestimiento. La penetración de agua o iones es una de las principales causas de la pérdida de la barrera, lo que puede provocar la delaminación del revestimiento y la corrosión debajo de la película. El enchapado, la pintura y la aplicación de esmalte son los tratamientos anticorrosión más habituales.
- Anodización. La anodización es un proceso de pasivación electrolítica que se utiliza para aumentar el grosor de la capa de óxido natural en la superficie de las piezas metálicas. Un número limitado de metales, como los aceros inoxidables, pueden alcanzar la pasividad. El proceso se llama anodizado porque la pieza a tratar forma el electrodo de ánodo de una celda electrolítica. Las aleaciones de aluminio generalmente se anodizan para aumentar la resistencia a la corrosión y permitir el teñido (coloración).
- Protección catódica. La protección catódica es una forma muy eficaz de protección contra la corrosión basada en el uso de un material más anódico que el metal a proteger. El metal protegido está conectado eléctricamente a otro metal que es más reactivo en el entorno particular. El metal que es menos resistente a la corrosión se convierte en ánodo y el metal con mayor resistencia a la corrosión se convierte en cátodo. La corrosión de la resistencia menos corrosiva suele aumentar y el ataque a material más resistente disminuye. Existe una diferencia en el potencial eléctrico entre los diferentes metales y sirve como fuerza motriz para el flujo de corriente eléctrica a través del corrosivo o electrolito. Los sistemas de protección catódica se utilizan con mayor frecuencia para proteger de la corrosión las estructuras metálicas enterradas o sumergidas, como tuberías y tanques de acero. Magnesio, zinc, y las aleaciones de aluminio son ánodos de sacrificio habituales. Los ánodos de magnesio se utilizan con mayor frecuencia para aplicaciones en suelos enterrados. El zinc se utiliza con mayor frecuencia para aplicaciones marinas de agua dulce y salada. Las aleaciones de aluminio se utilizan con mayor frecuencia para estructuras en alta mar.
- Inhibidores de corrosión .Si el ambiente está controlado (especialmente en sistemas de recirculación), a menudo se le pueden agregar inhibidores de corrosión. Estos productos químicos forman un revestimiento eléctricamente aislante o químicamente impermeable sobre las superficies metálicas expuestas, para suprimir las reacciones electroquímicas. Los inhibidores de la corrosión son sustancias químicas que, cuando se agregan en concentraciones relativamente bajas al medio ambiente, reducen la velocidad de un proceso corrosivo. La sustancia que actúa como inhibidor depende tanto del entorno corrosivo como de la aleación. Los inhibidores se utilizan normalmente en sistemas cerrados como radiadores de automóviles y calderas de vapor. Un ejemplo de este principio es el uso de anticongelante en automóviles. La eficacia de un inhibidor depende de varios mecanismos diferentes. Algunos reaccionan con las especies químicamente activas de la solución, mientras que otros reaccionan con la superficie corrosiva e interfieren con la reacción corrosiva o forman una fina capa protectora. Por ejemplo, el oxígeno generalmente se elimina mediante inhibidores reductores como aminas e hidrazinas. En este ejemplo, la hidracina convierte el oxígeno, un agente corrosivo común, en agua, que generalmente es benigna. Muchos inhibidores también son tóxicos y, por lo tanto, no son adecuados para su uso en todas las aplicaciones. Otra limitación de los inhibidores es que generalmente pierden la efectividad cuando aumenta la temperatura y la concentración del ambiente. un agente corrosivo común, al agua, que generalmente es benigno. Muchos inhibidores también son tóxicos y, por lo tanto, no son adecuados para su uso en todas las aplicaciones. Otra limitación de los inhibidores es que generalmente pierden la efectividad cuando aumenta la temperatura y la concentración del ambiente. un agente corrosivo común, al agua, que generalmente es benigno. Muchos inhibidores también son tóxicos y, por lo tanto, no son adecuados para su uso en todas las aplicaciones. Otra limitación de los inhibidores es que generalmente pierden la efectividad cuando aumenta la temperatura y la concentración del ambiente.
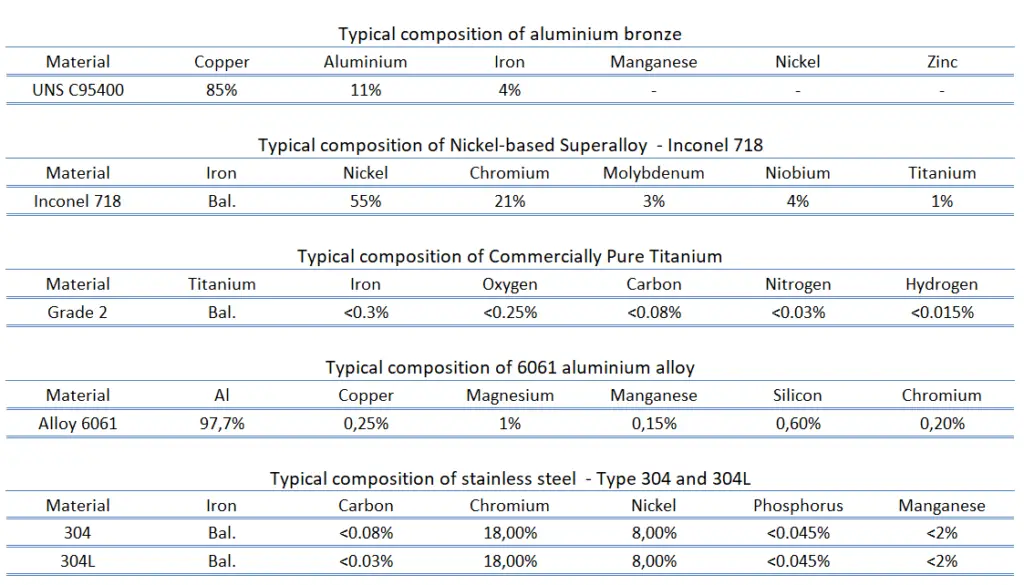
Aleaciones resistentes a la corrosión
Las aleaciones resistentes a la corrosión , como su nombre lo indica, son aleaciones con mayor resistencia a la corrosión . Algunos metales y aleaciones ferrosos y muchos no ferrosos se utilizan ampliamente en entornos corrosivos. En todos los casos, depende en gran medida de cierto entorno y otras condiciones. Las aleaciones resistentes a la corrosión se utilizan para tuberías de agua y muchas aplicaciones químicas e industriales. En el caso de las aleaciones ferrosas, hablamos de aceros inoxidables y, en cierta medida, de fundiciones. Pero algunas aleaciones no ferrosas resistentes a la corrosión exhiben una notable resistencia a la corrosión y, por lo tanto, pueden usarse para muchos propósitos especiales. Hay dos razones principales por las que se prefieren los materiales no ferrosos a los aceros y aceros inoxidables para muchas de estas aplicaciones. Por ejemplo, muchos de los Los metales y aleaciones no ferrosos poseen una resistencia a la corrosión mucho mayor que los aceros aleados y los grados de acero inoxidable disponibles. En segundo lugar, una alta relación resistencia-peso o una alta conductividad térmica y eléctrica pueden proporcionar una clara ventaja sobre una aleación ferrosa.
Pasivación
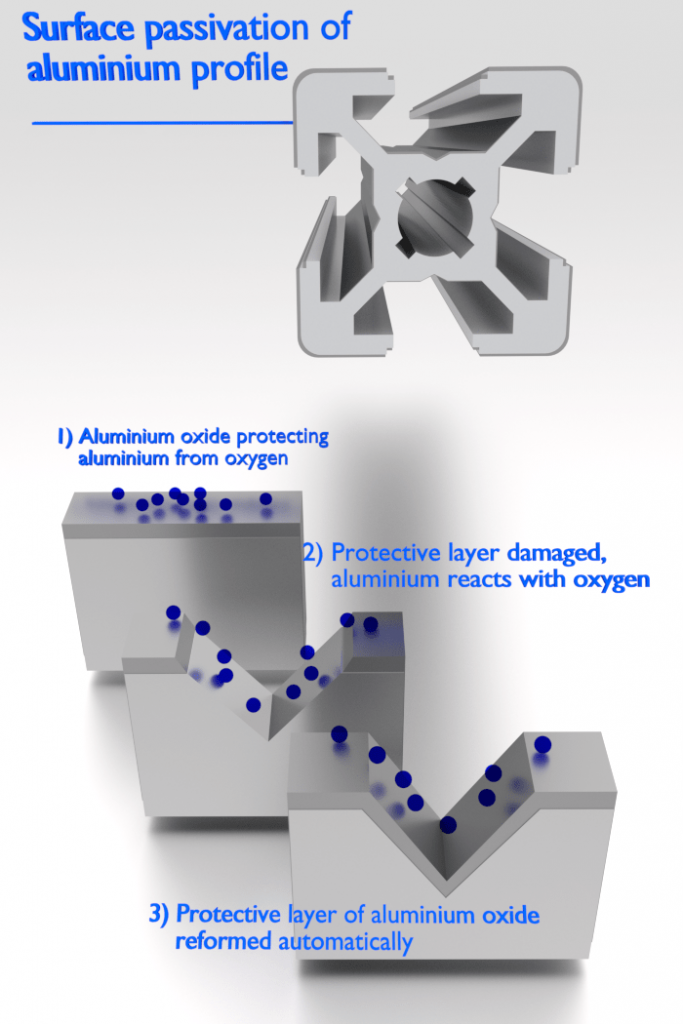 Hay metales que exhiben pasividad a la corrosión . La pasividad es la característica de un metal que se exhibe cuando ese metal no se activa en la reacción de corrosión. La pasivación es un proceso natural de acumulación de una capa estable y tenaz de óxido metálico o barrera protectora en la superficie del metal que actúa como una barrera que separa la superficie del metal del medio ambiente. La pasividad disminuye o detiene el proceso de corrosión debido a la formación de la capa. Afortunadamente, desde el punto de vista de la ingeniería, los metales más susceptibles a este tipo de comportamiento son los materiales de ingeniería y estructurales comunes, incluidos el hierro, el níquel, el silicio, el cromo, el titanio y las aleaciones que contienen estos metales.
Hay metales que exhiben pasividad a la corrosión . La pasividad es la característica de un metal que se exhibe cuando ese metal no se activa en la reacción de corrosión. La pasivación es un proceso natural de acumulación de una capa estable y tenaz de óxido metálico o barrera protectora en la superficie del metal que actúa como una barrera que separa la superficie del metal del medio ambiente. La pasividad disminuye o detiene el proceso de corrosión debido a la formación de la capa. Afortunadamente, desde el punto de vista de la ingeniería, los metales más susceptibles a este tipo de comportamiento son los materiales de ingeniería y estructurales comunes, incluidos el hierro, el níquel, el silicio, el cromo, el titanio y las aleaciones que contienen estos metales.
Por ejemplo, el acero inoxidable debe sus propiedades de resistencia a la corrosión a la formación de una película superficial pasiva autocurativa. Para que se produzca la pasivación y se mantenga estable, la aleación Fe-Cr debe tener un contenido mínimo de cromo de aproximadamente 10,5% en peso , por encima del cual puede producirse pasividad y por debajo del cual es imposible. Una vez que se limpia la superficie y la composición a granel del acero inoxidable se expone al aire, la película pasiva se forma inmediatamente.
El aluminio es muy resistente a la corrosión en muchos entornos porque también pasiva. Si se daña, la película protectora normalmente se vuelve a formar muy rápidamente. Sin embargo, un cambio en el carácter del medio ambiente (por ejemplo, una alteración en la concentración de las especies corrosivas activas) puede hacer que un material pasivado vuelva a su estado activo. Generalmente, a altas temperaturas (en agua, la corrosión limita el uso del aluminio a temperaturas cercanas a los 100 ° C), la resistencia relativamente baja y las malas propiedades de corrosión del aluminio lo hacen inadecuado como material estructural.
Esperamos que este artículo, Protección contra la corrosión , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.