 La corrosión es el deterioro de un material debido a la interacción química con su entorno. Es un proceso natural en el que los metales convierten su estructura en una forma más estable químicamente, como óxidos, hidróxidos o sulfuros. Las consecuencias de la corrosión son demasiado comunes. Los ejemplos familiares incluyen la oxidación de paneles y tuberías de la carrocería de automóviles y muchas herramientas. La corrosión suele ser un fenómeno negativo, ya que está asociado con la falla mecánica de un objeto. Los átomos de metal se eliminan de un elemento estructural hasta que falla, o los óxidos se acumulan dentro de una tubería hasta que se tapa. Todos los metales y aleaciones están sujetos a corrosión. Incluso los metales nobles, como el oro, están sujetos a un ataque corrosivo en algunos entornos.
La corrosión es el deterioro de un material debido a la interacción química con su entorno. Es un proceso natural en el que los metales convierten su estructura en una forma más estable químicamente, como óxidos, hidróxidos o sulfuros. Las consecuencias de la corrosión son demasiado comunes. Los ejemplos familiares incluyen la oxidación de paneles y tuberías de la carrocería de automóviles y muchas herramientas. La corrosión suele ser un fenómeno negativo, ya que está asociado con la falla mecánica de un objeto. Los átomos de metal se eliminan de un elemento estructural hasta que falla, o los óxidos se acumulan dentro de una tubería hasta que se tapa. Todos los metales y aleaciones están sujetos a corrosión. Incluso los metales nobles, como el oro, están sujetos a un ataque corrosivo en algunos entornos.
La mayoría de los metales no son termodinámicamente estables en forma metálica; quieren corroerse y volver a las formas más estables que se encuentran normalmente en los minerales, como los óxidos. La corrosión también puede ocurrir en materiales distintos de los metales, como cerámicas o polímeros, aunque en este contexto, el término «degradación» es más común. Los materiales cerámicos son relativamente resistentes al deterioro, que suele ocurrir a temperaturas elevadas o en entornos bastante extremos. Con frecuencia, el proceso también se denomina corrosión. En el caso de los polímeros, los mecanismos y las consecuencias difieren de los de los metales y las cerámicas, y el término degradación se utiliza con mayor frecuencia. La corrosión degrada las propiedades útiles de los materiales y estructuras, incluida la resistencia, apariencia y permeabilidad a líquidos y gases.
La corrosión es de naturaleza electroquímica porque las reacciones químicas corrosivas implican una transferencia de carga. La química de la corrosión es bastante compleja, pero puede considerarse esencialmente como un fenómeno electroquímico. Los iones metálicos se disuelven haciendo que el metal se cargue negativamente con respecto al electrolito. La diferencia en la carga hace que se desarrolle un potencial y produce un voltaje entre el electrolito y el metal.
La corrosión , como proceso natural y persistente, también implica el deterioro involuntario de los metales, a veces con resultados desastrosos. ¿Qué tan grande es el problema de la corrosión? El problema de la corrosión metálica es significativo. En términos económicos , se ha estimado que aproximadamente el 5% de los ingresos de una nación industrializada se gasta en la prevención de la corrosión y el mantenimiento o reemplazo de productos perdidos o contaminados como resultado de reacciones de corrosión.
La corrosión es la principal preocupación en las plantas de reactores nucleares. La corrosión se produce continuamente en toda la planta del reactor y todos los metales están sujetos a ella. Aunque esta corrosión no se puede eliminar, se puede controlar.
Pasivación
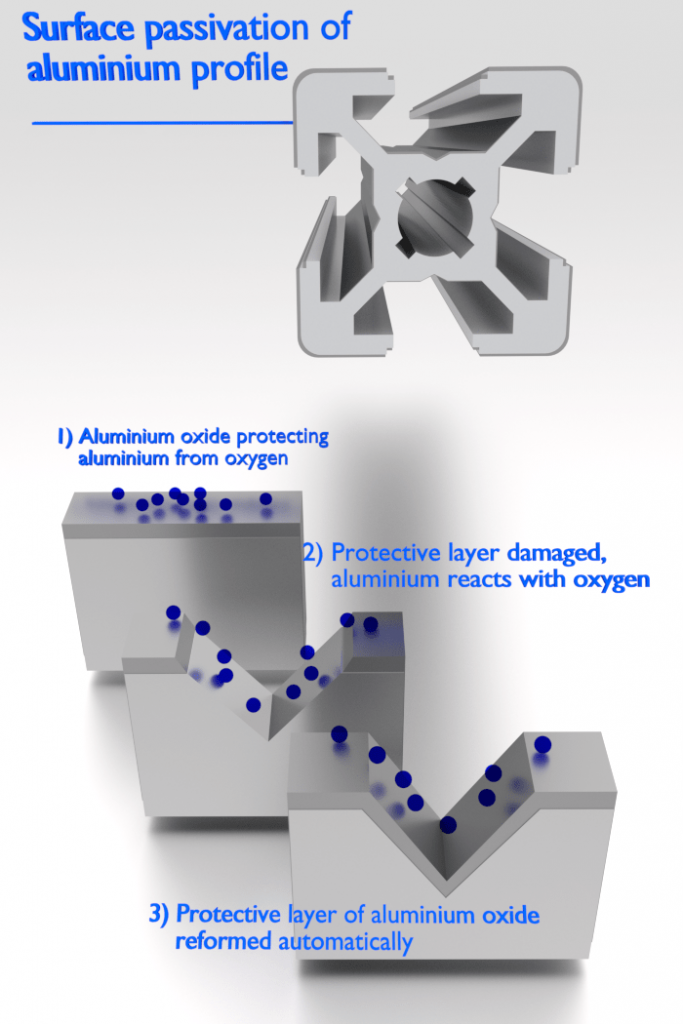 Hay metales que exhiben pasividad a la corrosión . La pasividad es la característica de un metal que se exhibe cuando ese metal no se activa en la reacción de corrosión. La pasivación es un proceso natural de acumulación de una capa estable y tenaz de óxido metálico o barrera protectora en la superficie del metal que actúa como una barrera que separa la superficie del metal del medio ambiente. La pasividad disminuye o detiene el proceso de corrosión debido a la formación de la capa. Afortunadamente, desde el punto de vista de la ingeniería, los metales más susceptibles a este tipo de comportamiento son los materiales de ingeniería y estructurales comunes, incluidos el hierro, el níquel, el silicio, el cromo, el titanio y las aleaciones que contienen estos metales.
Hay metales que exhiben pasividad a la corrosión . La pasividad es la característica de un metal que se exhibe cuando ese metal no se activa en la reacción de corrosión. La pasivación es un proceso natural de acumulación de una capa estable y tenaz de óxido metálico o barrera protectora en la superficie del metal que actúa como una barrera que separa la superficie del metal del medio ambiente. La pasividad disminuye o detiene el proceso de corrosión debido a la formación de la capa. Afortunadamente, desde el punto de vista de la ingeniería, los metales más susceptibles a este tipo de comportamiento son los materiales de ingeniería y estructurales comunes, incluidos el hierro, el níquel, el silicio, el cromo, el titanio y las aleaciones que contienen estos metales.
Por ejemplo, el acero inoxidable debe sus propiedades de resistencia a la corrosión a la formación de una película superficial pasiva autocurativa. Para que se produzca la pasivación y se mantenga estable, la aleación Fe-Cr debe tener un contenido mínimo de cromo de aproximadamente 10,5% en peso , por encima del cual puede producirse pasividad y por debajo del cual es imposible. Una vez que se limpia la superficie y la composición a granel del acero inoxidable se expone al aire, la película pasiva se forma inmediatamente.
El aluminio es muy resistente a la corrosión en muchos entornos porque también pasiva. Si se daña, la película protectora normalmente se vuelve a formar muy rápidamente. Sin embargo, un cambio en el carácter del medio ambiente (por ejemplo, una alteración en la concentración de las especies corrosivas activas) puede hacer que un material pasivado vuelva a su estado activo. Generalmente, a altas temperaturas (en agua, la corrosión limita el uso del aluminio a temperaturas cercanas a los 100 ° C), la resistencia relativamente baja y las malas propiedades de corrosión del aluminio lo hacen inadecuado como material estructural.
Formas de corrosión
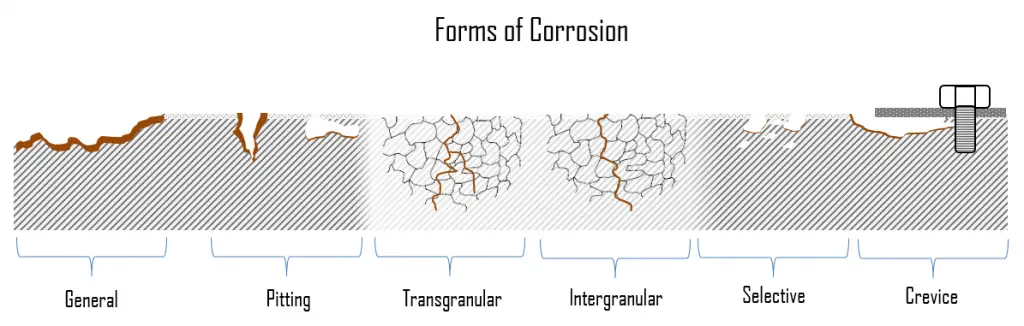
Durante la corrosión del metal, las áreas sobre las que ocurren las reacciones anódicas y catódicas pueden variar mucho. La corrosión puede presentarse en diferentes formas y crecer a diferentes velocidades. Esto da como resultado varias formas de corrosión, como ataque uniforme, picaduras y corrosión por grietas. El problema es que existen muchas formas de corrosión y cada una es causada por diferentes razones y experimenta diferentes mecanismos. Además, cada forma de corrosión tiene su propio mecanismo especial, que puede ser bastante complejo en algunos casos. Esto es especialmente problemático cuando se producen simultáneamente dos o más tipos de corrosión.
En la siguiente sección, describiremos brevemente las formas más comunes de corrosión . Básicamente se dividen en dos subcategorías: general (uniforme) y forma de corrosión localizada.
- Corrosión general . La corrosión general, también conocida como corrosión uniforme, es una forma de corrosión que afecta a toda la superficie del metal, mientras que otras formas afectan un punto o porción específica. Este tipo de corrosión se observa comúnmente en metales puros que son metalúrgicos y de composición uniforme. Es una reacción muy lenta que se distribuye de manera bastante uniforme por toda la superficie metálica expuesta al agua en circulación. El hecho de que afecte a un área bastante grande del metal hace que sea mucho más fácil de detectar y, por lo tanto, mucho menos grave que la corrosión localizada. El problema de la corrosión general es que da como resultado un gran volumen de óxidos que tienden a adherirse a las superficies de transferencia de calor y afectan la eficiencia del sistema.
- Corrosión localizada . En la corrosión localizada hay un ataque intenso en sitios localizados en la superficie de un componente, mientras que el resto de la superficie se corroe a un ritmo mucho menor. La corrosión localizada tiene lugar cuando la corrosión se combina con otros procesos destructivos como el estrés, la fatiga, la erosión y otras formas de ataque químico.
Corrosión general
La corrosión general , también conocida como corrosión uniforme, es una forma de corrosión que afecta a toda la superficie del metal, mientras que otras formas afectan un punto o porción específica. Es la forma más común de corrosión. Este tipo de corrosión se observa comúnmente en metales puros que son metalúrgicos y de composición uniforme. Los aceros resistentes a la intemperie , las aleaciones de magnesio , las aleaciones de zinc y las aleaciones de cobre son ejemplos de materiales que típicamente exhiben corrosión generalizada. Los materiales pasivos, como los aceros inoxidables , las aleaciones de aluminio o las aleaciones de níquel-cromo, generalmente están sujetos a corrosión localizada.
Es una reacción muy lenta que se distribuye de manera bastante uniforme por toda la superficie metálica expuesta al agua en circulación. El hecho de que afecte a un área bastante grande del metal hace que sea mucho más fácil de detectar y, por lo tanto, mucho menos grave que la corrosión localizada. El problema de la corrosión general es que da como resultado un gran volumen de óxidos que tienden a adherirse a las superficies de transferencia de calor y afectan la eficiencia del sistema.
Corrosión general – Protección
Algunos métodos estándar asociados con la selección de materiales que protegen contra la corrosión general incluyen:
- El uso de materiales resistentes a la corrosión como acero inoxidable y aleaciones de níquel, cromo y molibdeno.
- El uso de recubrimientos protectores como pinturas y epoxis.
- La aplicación de revestimientos o revestimientos metálicos y no metálicos a la superficie que protege contra la corrosión, pero permite que el material retenga su resistencia estructural (por ejemplo, un recipiente a presión de acero al carbono con revestimiento de acero inoxidable como revestimiento).
Corrosión localizada
En la corrosión localizada hay un ataque intenso en sitios localizados en la superficie de un componente, mientras que el resto de la superficie se corroe a una velocidad mucho menor. La corrosión localizada tiene lugar cuando la corrosión se combina con otros procesos destructivos como el estrés, la fatiga, la erosión y otras formas de ataque químico. Los mecanismos de corrosión localizados pueden causar más daño que cualquiera de esos procesos destructivos individualmente. La corrosión localizada puede clasificarse además como corrosión por picaduras, corrosión galvánica, corrosión por grietas, corrosión selectiva, corrosión por erosión, corrosión intergranular, corrosión por tensión por cloruro y agrietamiento por corrosión por tensión (SCC). Los materiales pasivos, como los aceros inoxidables, las aleaciones de aluminio o las aleaciones de níquel-cromo, generalmente están sujetos a corrosión localizada.
Corrosión por picadura
Las picaduras, caracterizadas por agujeros muy definidos, es una de las formas más insidiosas de corrosión. Por lo general, penetran desde la parte superior de una superficie horizontal hacia abajo en una dirección casi vertical. Se supone que la gravedad hace que las fosas crezcan hacia abajo. La corrosión por picaduras puede causar fallas por perforación y producir solo una pequeña pérdida de peso en el metal. Esta perforación puede ser difícil de detectar y su crecimiento es rápido, lo que conduce a una pérdida inesperada de función del componente. La corrosión por picadura también se ha asociado con la corrosión galvánica y por grietas. La deposición de metal (iones de cobre plateados sobre una superficie de acero) también puede crear sitios para el ataque de picaduras.
Las causas de la corrosión por picaduras incluyen:
- Falta de homogeneidad local en la superficie del metal.
- Pérdida local de pasividad
- Rotura mecánica o química de una capa protectora de óxido.
- Corrosión galvánica de un cátodo relativamente distante
Con las aleaciones resistentes a la corrosión, como los aceros inoxidables, la causa más común de corrosión por picaduras es la destrucción altamente localizada de la pasividad por contacto con la humedad que contiene iones haluro, particularmente cloruros. Sin embargo, la aleación con aproximadamente un 2% de molibdeno mejora significativamente su resistencia. La picadura inducida por cloruro de los aceros inoxidables generalmente da como resultado un socavado, produciendo cavidades subterráneas agrandadas o cavernas.
Corrosión por picaduras – Protección
La corrosión por picaduras es un peligro debido a la posible rápida penetración del metal con poca pérdida total de masa. La corrosión por picaduras se minimiza mediante:
- Evitando condiciones estancadas
- Usar los metales y aleaciones correctos que son menos susceptibles a la corrosión.
- Evitar agentes en el medio que causan picaduras.
- Diseñar el sistema y los componentes de manera que no haya grietas.
Corrosión por grietas
La corrosión por grietas se refiere a la corrosión localizada que se produce en la hendidura o espacio entre dos o más metales de unión. La corrosión por grietas es un tipo de corrosión por picaduras que ocurre específicamente dentro de la región de bajo flujo de una grieta. Este tipo de ataque generalmente se asocia con pequeños volúmenes de solución estancada causados por orificios, superficie de juntas, juntas traslapadas, depósitos en la superficie y hendiduras debajo de las cabezas de los pernos y remaches. El daño se produce debido a la diferencia en la concentración de componentes, principalmente oxígeno, en las superficies involucradas. La corrosión por grietas puede progresar muy rápidamente (decenas a cientos de veces más rápido que la velocidad normal de corrosión general en la misma solución dada).
La corrosión por grietas es un peligro debido a la posible rápida penetración del metal con poca pérdida total de masa. La corrosión por grietas se minimiza mediante:
- La corrosión por grietas se puede prevenir utilizando juntas soldadas en lugar de remachadas o atornilladas.
- Usar los metales y aleaciones correctos que son menos susceptibles a la corrosión.
- Evitar agentes en el medio que causan picaduras.
- Diseñar el sistema y los componentes de manera que no haya grietas.
Corrosión galvánica
La corrosión galvánica ocurre cuando dos metales diferentes se sumergen en una solución conductora en presencia de alguna diferencia de potencial y hay un flujo de electrones entre los metales. También puede tener lugar con un metal con heterogeneidades (disimilitudes) (por ejemplo, inclusiones de impurezas, granos de diferentes tamaños, diferencia en la composición de los granos o diferencias en la tensión mecánica). El metal que es menos resistente a la corrosión se convierte en ánodo y el metal con mayor resistencia a la corrosión se convierte en cátodo. La corrosión de la resistencia menos corrosiva suele aumentar y el ataque a material más resistente disminuye. Existe una diferencia en el potencial eléctrico entre los diferentes metales y sirve como fuerza motriz para el flujo de corriente eléctrica a través del corrosivo o electrolito.
La corrosión galvánica ocurre solo si se cumplen las siguientes condiciones:
- Deben estar presentes dos metales diferentes
- Los dos metales deben estar en contacto o debe haber una ruta conductora de electricidad entre los dos.
- Debe haber una ruta eléctricamente conductora para que los iones se muevan del «ánodo» al «cátodo».
Si no se cumple alguna de estas condiciones, no es probable que se produzca corrosión galvánica.
La corrosión galvánica solo provoca el deterioro de uno de los metales. El más fuerte, más noble es catódico (positivo) y protegido. Este es el mecanismo de los ánodos galvánicos, que son el componente principal de un sistema de protección catódica galvánica (CP) que se utiliza para proteger de la corrosión las estructuras metálicas enterradas o sumergidas. En algunos casos, la corrosión galvánica puede resultar útil.
Lixiviación selectiva – Corrosión selectiva
La lixiviación selectiva o la corrosión selectiva es la eliminación de un elemento de una aleación sólida mediante un proceso de corrosión. El ejemplo más común es la deszincificación del latón , en la que el zinc se lixivia selectivamente de una aleación de latón de cobre y zinc. Este proceso produce una estructura de cobre porosa debilitada. La eliminación selectiva de zinc puede ser de manera uniforme o localizada.
Sin embargo, muchas aleaciones están sujetas a lixiviación selectiva en determinadas condiciones. Un proceso similar ocurre en otros sistemas de aleación en los que se eliminan el aluminio, el hierro, el cobalto, el cromo y otros elementos. Los elementos de una aleación que son más resistentes al medio ambiente quedan atrás. Están involucrados dos mecanismos:
- Se disuelven dos metales de una aleación; un metal vuelve a depositarse en la superficie de los elementos supervivientes.
- Un metal se disuelve selectivamente, dejando atrás los otros metales.
El primer sistema está involucrado en la descincificación de latones, y el segundo sistema está involucrado cuando el molibdeno se elimina de las aleaciones de níquel en hidróxido de sodio fundido.
Corrosión por erosión
La corrosión por erosión es el daño acumulativo inducido por las reacciones de corrosión electroquímica y los efectos mecánicos del movimiento relativo entre el electrolito y la superficie corroída. La erosión también puede ocurrir en combinación con otras formas de degradación, como la corrosión. Esto se conoce como erosión-corrosión. La corrosión por erosión es un proceso de degradación del material debido al efecto combinado de corrosión y desgaste. Casi todos los medios corrosivos que fluyen o turbulentos pueden causar corrosión por erosión. El mecanismo se puede describir de la siguiente manera:
- erosión mecánica del material, o capa protectora (o pasiva) de óxido en su superficie,
- Mayor corrosión del material, si la velocidad de corrosión del material depende del espesor de la capa de óxido.
La corrosión por erosión se encuentra en sistemas como tuberías, válvulas, bombas, boquillas, intercambiadores de calor y turbinas. El desgaste es un proceso de degradación mecánica del material que se produce al frotar o impactar superficies, mientras que la corrosión implica reacciones químicas o electroquímicas del material. La corrosión puede acelerar el desgaste y el desgaste puede acelerar la corrosión.
Corrosión intergranular – Decaimiento de la soldadura
La corrosión intergranular (IGC) es una corrosión preferencial a lo largo de los límites de grano de un material. para algunas aleaciones y en entornos específicos. Este tipo de corrosión es especialmente frecuente en algunos aceros inoxidables. En los aceros inoxidables, la corrosión intergranular puede ocurrir como consecuencia de la precipitación de carburos de cromo (Cr 23 C 6 ) o fases intermetálicas.
La resistencia de estas aleaciones metálicas a los efectos químicos de los agentes corrosivos se basa en la pasivación . Para que se produzca la pasivación y se mantenga estable, la aleación Fe-Cr debe tener un contenido mínimo de cromo de aproximadamente 10,5% en peso , por encima del cual puede producirse pasividad y por debajo del cual es imposible. Pero los carburos de cromo pueden precipitar en los límites de los granos, lo que da como resultado el agotamiento del cromo en las zonas cercanas a los límites de los granos debido a la velocidad de difusión del cromo que es lenta. Las zonas empobrecidas en cromo se vuelven menos resistentes a la corrosión que el resto de la matriz. En un ambiente corrosivo, las áreas agotadas pueden activarse y se producirá corrosión en áreas muy estrechas entre los granos.
La corrosión intergranular es un problema especialmente severo en la soldadura de aceros inoxidables, cuando a menudo se denomina decaimiento de la soldadura . También se sensibiliza un acero inoxidable, que ha sido tratado térmicamente de manera que produce precipitados en los límites de grano y zonas adyacentes empobrecidas en cromo. Los aceros inoxidables pueden estabilizarse contra este comportamiento mediante la adición de titanio, niobio o tántalo, que forman carburo de titanio, carburo de niobio y carburo de tántalo preferentemente al carburo de cromo, reduciendo el contenido de carbono en el acero y, en caso de soldadura, también en el metal de aportación por debajo del 0,02%, o calentando toda la parte por encima de 1000 ° C y enfriándola en agua, lo que lleva a la disolución del carburo de cromo en los granos y luego evita su precipitación.
Hay dos casos especiales de corrosión intergranular, pero estos mecanismos se tratan por separado:
- Corrosión bajo tensión. La corrosión intergranular inducida por tensiones ambientales se denomina agrietamiento por corrosión bajo tensión.
- Agrietamiento por corrosión bajo tensión por cloruro. La corrosión intergranular inducida por la acción combinada de las tensiones ambientales y el cloro se denomina agrietamiento por corrosión bajo tensión por cloruro.
Agrietamiento por corrosión bajo tensión – SCC
Uno de los problemas metalúrgicos más graves y uno de los principales problemas de la industria nuclear es el agrietamiento por corrosión bajo tensión (SCC). El agrietamiento por corrosión bajo tensión es el resultado de la acción combinada de una tensión de tracción aplicada y un entorno corrosivo., ambas influencias son necesarias. El SCC es un tipo de corrosión por ataque intergranular que se produce en los límites del grano bajo tensión de tracción. Tiende a propagarse a medida que la tensión abre grietas que están sujetas a corrosión, que luego se corroen aún más, debilitando el metal al agrietarse aún más. Las fisuras pueden seguir trayectorias intergranulares o transgranulares y, a menudo, existe una tendencia a la ramificación de las fisuras. El comportamiento de falla es característico del de un material frágil, aunque la aleación de metal es intrínsecamente dúctil. El SCC puede provocar una falla repentina inesperada de las aleaciones de metales normalmente dúctiles sometidas a un esfuerzo de tracción, especialmente a temperaturas elevadas. El SCC es químicamente muy específico en el sentido de que es probable que ciertas aleaciones se sometan a SCC solo cuando se exponen a una pequeña cantidad de entornos químicos.
Ver también: Agrietamiento por corrosión bajo tensión
Los medios más eficaces para prevenir el SCC en los sistemas de reactores son:
- diseñando correctamente
- reduciendo estrés
- eliminar especies ambientales críticas como hidróxidos, cloruros y oxígeno
- evitando áreas estancadas y grietas en intercambiadores de calor donde el cloruro y el hidróxido pueden concentrarse.
Agrietamiento por corrosión por tensión por cloruro
La corrosión por tensión por cloruro ocurre en aceros inoxidables austeníticos bajo tensión de tracción en presencia de oxígeno, iones de cloruro y alta temperatura. Es una de las formas más importantes de corrosión bajo tensión que concierne a la industria nuclear. Los aceros inoxidables austeníticos contienen entre 16 y 25% de Cr y también pueden contener nitrógeno en solución, los cuales contribuyen a su relativamente alta resistencia a la corrosión uniforme. Un tipo de corrosión que puede atacar el acero inoxidable austenítico es la corrosión por tensión por cloruro.
Las tres condiciones que deben estar presentes para que ocurra la corrosión bajo tensión por cloruro son las siguientes:
- Los iones de cloruro están presentes en el medio ambiente.
- El oxígeno disuelto está presente en el medio ambiente.
- El metal está bajo tensión de tracción
La corrosión bajo tensión por cloruro implica el ataque selectivo del metal a lo largo de los límites de los granos. La resistencia de estas aleaciones metálicas a los efectos químicos de los agentes corrosivos se basa en la pasivación . Para que se produzca la pasivación y se mantenga estable, la aleación Fe-Cr debe tener un contenido mínimo de cromo de aproximadamente el 10,5% en peso., por encima del cual puede ocurrir la pasividad y por debajo del cual es imposible. Pero los carburos de cromo pueden precipitar en los límites de los granos, lo que da como resultado el agotamiento del cromo en las zonas cercanas a los límites de los granos debido a la velocidad de difusión del cromo que es lenta. Las zonas empobrecidas en cromo se vuelven menos resistentes a la corrosión que el resto de la matriz. En un ambiente corrosivo, las áreas agotadas pueden activarse y se producirá corrosión en áreas muy estrechas entre los granos.
Se ha encontrado que esto está estrechamente asociado con ciertos tratamientos térmicos resultantes de la soldadura. Esto se puede minimizar considerablemente mediante procesos de recocido adecuados. Esta forma de corrosión se controla manteniendo un bajo contenido de iones de cloruro y oxígeno en el medio ambiente y el uso de aceros con bajo contenido de carbono. Los aceros inoxidables ferríticos se eligen por su resistencia al agrietamiento por corrosión bajo tensión, lo que los convierte en una alternativa atractiva a los aceros inoxidables austeníticos en aplicaciones donde prevalece el SCC inducido por cloruro.
Protección contra la corrosión
Como se escribió, el problema de la corrosión metálica es significativo. En términos económicos, se ha estimado que aproximadamente el 5% de los ingresos de una nación industrializada se gasta en la prevención de la corrosión y el mantenimiento o reemplazo de productos perdidos o contaminados como resultado de reacciones de corrosión. Por lo tanto, se utilizan varios tratamientos para retardar el daño por corrosión de los objetos metálicos que están expuestos a la intemperie, agua salada, ácidos u otros entornos hostiles. Dado que existen muchas formas de corrosión, existen muchas formas de detener o mitigar la corrosión. En todos los casos, depende del material a proteger y también del entorno en el que se utiliza el material. Los metales pueden protegerse de la corrosión utilizando un metal en un entorno en el que sea inmune, creando una barrera física entre el metal y su entorno.
- Selección de material . Quizás la forma más común y fácil de prevenir la corrosión es mediante la selección juiciosa de materiales una vez que se ha caracterizado el entorno de corrosión. Algunos metales y aleaciones ferrosos y muchos no ferrosos se utilizan ampliamente en entornos corrosivos. En todos los casos, depende en gran medida de cierto entorno y otras condiciones. Aquí, el costo puede ser un factor importante. No siempre es económicamente viable emplear el material que proporcione la resistencia óptima a la corrosión.
- Tratamiento superficial anticorrosión . Un recubrimiento proporciona protección al formar una barrera física entre el sustrato metálico y un ambiente corrosivo acuoso. Los recubrimientos protegen las estructuras metálicas de la corrosión mediante efectos de inhibición y barrera. El efecto barrera depende de la adhesión a la capa inferior, pero también de las propiedades no conductoras del revestimiento. La penetración de agua o iones es una de las principales causas de la pérdida de la barrera, lo que puede provocar la delaminación del revestimiento y la corrosión debajo de la película. El enchapado, la pintura y la aplicación de esmalte son los tratamientos anticorrosión más habituales.
- Anodización. La anodización es un proceso de pasivación electrolítica que se utiliza para aumentar el grosor de la capa de óxido natural en la superficie de las piezas metálicas. Un número limitado de metales, como los aceros inoxidables, pueden alcanzar la pasividad. El proceso se llama anodizado porque la pieza a tratar forma el electrodo de ánodo de una celda electrolítica. Las aleaciones de aluminio generalmente se anodizan para aumentar la resistencia a la corrosión y permitir el teñido (coloración).
- Protección catódica. La protección catódica es una forma muy eficaz de protección contra la corrosión basada en el uso de un material más anódico que el metal a proteger. El metal protegido está conectado eléctricamente a otro metal que es más reactivo en el entorno particular. El metal que es menos resistente a la corrosión se convierte en ánodo y el metal con mayor resistencia a la corrosión se convierte en cátodo. La corrosión de la resistencia menos corrosiva suele aumentar y el ataque a material más resistente disminuye. Existe una diferencia en el potencial eléctrico entre los diferentes metales y sirve como fuerza motriz para el flujo de corriente eléctrica a través del corrosivo o electrolito. Los sistemas de protección catódica se utilizan con mayor frecuencia para proteger de la corrosión las estructuras metálicas enterradas o sumergidas, como tuberías y tanques de acero. Magnesio, zinc, y las aleaciones de aluminio son ánodos de sacrificio habituales. Los ánodos de magnesio se utilizan más comúnmente para aplicaciones en suelos enterrados. El zinc se utiliza con mayor frecuencia para aplicaciones marinas de agua dulce y salada. Las aleaciones de aluminio se utilizan con mayor frecuencia para estructuras en alta mar.
- Inhibidores de corrosión .Si el ambiente está controlado (especialmente en sistemas de recirculación), a menudo se le pueden agregar inhibidores de corrosión. Estos productos químicos forman un revestimiento eléctricamente aislante o químicamente impermeable sobre las superficies metálicas expuestas, para suprimir las reacciones electroquímicas. Los inhibidores de la corrosión son sustancias químicas que, cuando se agregan en concentraciones relativamente bajas al medio ambiente, reducen la velocidad de un proceso corrosivo. La sustancia que actúa como inhibidor depende tanto del entorno corrosivo como de la aleación. Los inhibidores se utilizan normalmente en sistemas cerrados como radiadores de automóviles y calderas de vapor. Un ejemplo de este principio es el uso de anticongelante en automóviles. La eficacia de un inhibidor depende de varios mecanismos diferentes. Algunos reaccionan con las especies químicamente activas de la solución, mientras que otros reaccionan con la superficie corrosiva e interfieren con la reacción corrosiva o forman una fina capa protectora. Por ejemplo, el oxígeno generalmente se elimina mediante inhibidores reductores como aminas e hidrazinas. En este ejemplo, la hidracina convierte el oxígeno, un agente corrosivo común, en agua, que generalmente es benigna. Muchos inhibidores también son tóxicos y, por lo tanto, no son adecuados para su uso en todas las aplicaciones. Otra limitación de los inhibidores es que generalmente pierden la efectividad cuando aumenta la temperatura y la concentración del ambiente. un agente corrosivo común, al agua, que generalmente es benigno. Muchos inhibidores también son tóxicos y, por lo tanto, no son adecuados para su uso en todas las aplicaciones. Otra limitación de los inhibidores es que generalmente pierden la efectividad cuando aumenta la temperatura y la concentración del ambiente. un agente corrosivo común, al agua, que generalmente es benigno. Muchos inhibidores también son tóxicos y, por lo tanto, no son adecuados para su uso en todas las aplicaciones. Otra limitación de los inhibidores es que generalmente pierden la efectividad cuando aumenta la temperatura y la concentración del ambiente.
Aleaciones resistentes a la corrosión
Las aleaciones resistentes a la corrosión , como su nombre lo indica, son aleaciones con mayor resistencia a la corrosión . Algunos metales y aleaciones ferrosos y muchos no ferrosos se utilizan ampliamente en entornos corrosivos. En todos los casos, depende en gran medida de cierto entorno y otras condiciones. Las aleaciones resistentes a la corrosión se utilizan para tuberías de agua y muchas aplicaciones químicas e industriales. En el caso de las aleaciones ferrosas, hablamos de aceros inoxidables y, en cierta medida, de fundiciones. Pero algunas aleaciones no ferrosas resistentes a la corrosión exhiben una notable resistencia a la corrosión y, por lo tanto, pueden usarse para muchos propósitos especiales. Hay dos razones principales por las que se prefieren los materiales no ferrosos a los aceros y aceros inoxidables para muchas de estas aplicaciones. Por ejemplo, muchos de los Los metales y aleaciones no ferrosos poseen una resistencia a la corrosión mucho mayor que los aceros aleados y los grados de acero inoxidable disponibles. En segundo lugar, una alta relación resistencia-peso o una alta conductividad térmica y eléctrica pueden proporcionar una clara ventaja sobre una aleación ferrosa.
CRUD en centrales eléctricas
En ingeniería nuclear, » CRUD » es un término técnico para los productos de corrosión y desgaste (partículas de óxido, etc.) en el refrigerante que se vuelven radiactivos cuando se exponen a la radiación. El término es en realidad un acrónimo de Depósitos no identificados de Chalk River, que originalmente se encuentra en el revestimiento o revestimiento exterior de las barras de combustible en el reactor canadiense por el que recibió su nombre. CRUD puede definirse como productos de corrosión circulantes depositados o suspendidos, principalmente óxidos metálicos, formados por la reacción del agua con los materiales de las tuberías. Según la ICRP, el CRUD formado en las centrales eléctricas es la principal fuente de exposición a la radiación del operador.
Además de estos aspectos radiológicos, los CRUD pueden tener una serie de efectos adversos en la planta y sus componentes. Estos pueden incluir lo siguiente:
- Ensuciamiento mecánico de equipos.
- Aumento de la caída de presión en el núcleo.
La planta de energía debe diseñarse para minimizar la corrosión y la deposición. Este diseño incluye la eliminación eficiente de los productos de la corrosión, el sistema de purificación, el diseño y la disposición del equipo para minimizar la deposición de suciedad y la selección de la química del refrigerante para reducir la corrosión.
Esperamos que este artículo, Corrosión , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.