 La corrosion est la détérioration d’un matériau due à une interaction chimique avec son environnement. C’est un processus naturel dans lequel les métaux convertissent sa structure en une forme plus stable chimiquement, telle que des oxydes, des hydroxydes ou des sulfures. Les conséquences de la corrosion ne sont que trop courantes. Des exemples familiers incluent la rouille des panneaux de carrosserie et des tuyauteries automobiles et de nombreux outils. La corrosion est généralement un phénomène négatif, car elle est associée à une défaillance mécanique d’un objet. Les atomes métalliques sont retirés d’un élément structurel jusqu’à ce qu’il tombe en panne, ou des oxydes s’accumulent à l’intérieur d’un tuyau jusqu’à ce qu’il soit bouché. Tous les métaux et alliages sont sujets à la corrosion. Même les métaux nobles, tels que l’or, sont soumis à une attaque corrosive dans certains environnements.
La corrosion est la détérioration d’un matériau due à une interaction chimique avec son environnement. C’est un processus naturel dans lequel les métaux convertissent sa structure en une forme plus stable chimiquement, telle que des oxydes, des hydroxydes ou des sulfures. Les conséquences de la corrosion ne sont que trop courantes. Des exemples familiers incluent la rouille des panneaux de carrosserie et des tuyauteries automobiles et de nombreux outils. La corrosion est généralement un phénomène négatif, car elle est associée à une défaillance mécanique d’un objet. Les atomes métalliques sont retirés d’un élément structurel jusqu’à ce qu’il tombe en panne, ou des oxydes s’accumulent à l’intérieur d’un tuyau jusqu’à ce qu’il soit bouché. Tous les métaux et alliages sont sujets à la corrosion. Même les métaux nobles, tels que l’or, sont soumis à une attaque corrosive dans certains environnements.
La plupart des métaux ne sont pas thermodynamiquement stables sous forme métallique; ils veulent se corroder et revenir aux formes plus stables que l’on trouve normalement dans les minerais, comme les oxydes. La corrosion peut également se produire dans des matériaux autres que les métaux, tels que la céramique ou les polymères, bien que dans ce contexte, le terme « dégradation » soit plus courant. Les matériaux céramiques sont relativement résistants à la détérioration, qui se produit généralement à des températures élevées ou dans des environnements plutôt extrêmes. Le processus est souvent aussi appelé corrosion. Pour les polymères, les mécanismes et les conséquences diffèrent de ceux des métaux et des céramiques, et le terme de dégradation est le plus fréquemment utilisé. La corrosion dégrade les propriétés utiles des matériaux et des structures, notamment la résistance, l’apparence et la perméabilité aux liquides et aux gaz.
La corrosion est de nature électrochimique car les réactions chimiques corrosives impliquent un transfert de charge. La chimie de la corrosion est assez complexe mais elle peut être considérée essentiellement comme un phénomène électrochimique. Les ions métalliques entrent en solution, ce qui entraîne une charge négative du métal par rapport à l’électrolyte. La différence de charge provoque le développement d’un potentiel et produit une tension entre l’électrolyte et le métal.
La corrosion, en tant que processus naturel et persistant, implique également une détérioration involontaire des métaux, parfois avec des résultats désastreux. Quelle est l’ampleur du problème de corrosion ? Le problème de la corrosion métallique est important. En termes économiques, on a estimé qu’environ 5 % des revenus d’un pays industrialisé sont consacrés à la prévention de la corrosion et à l’entretien ou au remplacement des produits perdus ou contaminés à la suite de réactions de corrosion.
La corrosion est une préoccupation majeure dans les centrales nucléaires. La corrosion se produit en permanence dans toute la centrale du réacteur et chaque métal y est soumis. Même si cette corrosion ne peut pas être éliminée, elle peut être contrôlée.
Passivation
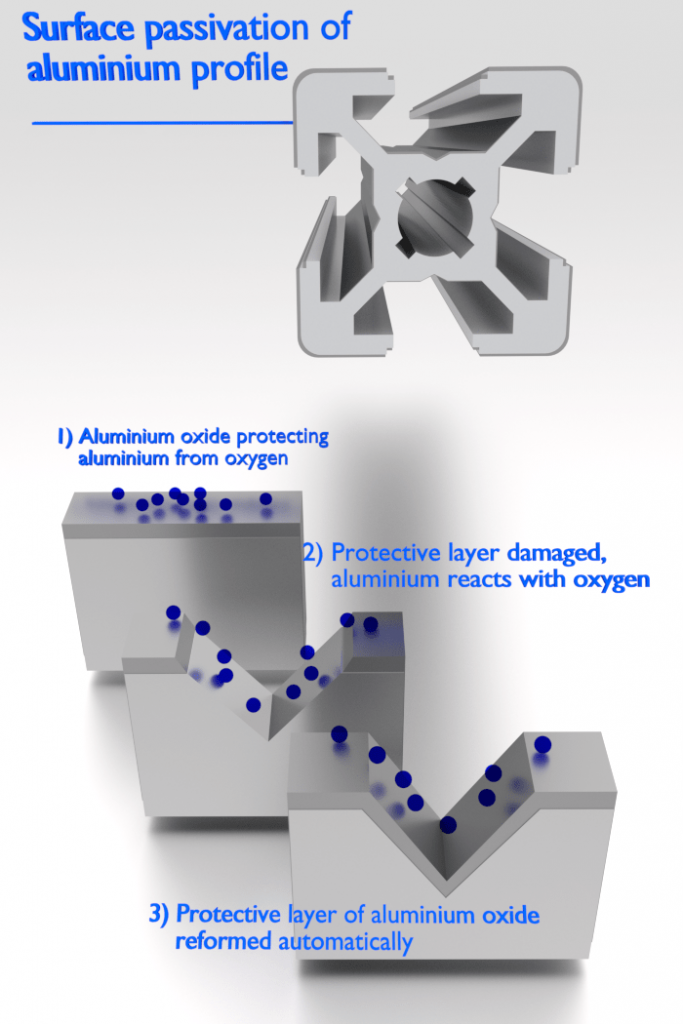 Il existe des métaux qui présentent une passivité à la corrosion. La passivité est la caractéristique d’un métal présenté lorsque ce métal ne devient pas actif dans la réaction de corrosion. La passivation est un processus naturel d’accumulation d’une couche stable et tenace d’oxyde métallique ou d’une barrière protectrice à la surface du métal qui agit comme une barrière séparant la surface métallique de l’environnement. La passivité diminue ou arrête le processus de corrosion en raison de la formation de la couche. Heureusement, d’un point de vue technique, les métaux les plus sensibles à ce type de comportement sont les matériaux d’ingénierie et de structure courants, notamment le fer, le nickel, le silicium, le chrome, le titane et les alliages contenant ces métaux.
Il existe des métaux qui présentent une passivité à la corrosion. La passivité est la caractéristique d’un métal présenté lorsque ce métal ne devient pas actif dans la réaction de corrosion. La passivation est un processus naturel d’accumulation d’une couche stable et tenace d’oxyde métallique ou d’une barrière protectrice à la surface du métal qui agit comme une barrière séparant la surface métallique de l’environnement. La passivité diminue ou arrête le processus de corrosion en raison de la formation de la couche. Heureusement, d’un point de vue technique, les métaux les plus sensibles à ce type de comportement sont les matériaux d’ingénierie et de structure courants, notamment le fer, le nickel, le silicium, le chrome, le titane et les alliages contenant ces métaux.
Par exemple, l’acier inoxydable doit ses propriétés de résistance à la corrosion à la formation d’un film de surface passif autocicatrisant. Pour que la passivation se produise et reste stable, l’ alliage Fe-Cr doit avoir une teneur minimale en chrome d’environ 10,5 % en poids, au-dessus de laquelle la passivation peut se produire et en dessous de laquelle elle est impossible. Une fois que la surface est nettoyée et que la composition en vrac de l’acier inoxydable est exposée à l’air, le film passif se forme immédiatement.
L’aluminium est très résistant à la corrosion dans de nombreux environnements car il passive également. S’il est endommagé, le film protecteur se reforme normalement très rapidement. Cependant, un changement dans le caractère de l’environnement (par exemple, une modification de la concentration des espèces corrosives actives) peut amener un matériau passivé à revenir à un état actif. Généralement, à des températures élevées (dans l’eau, la corrosion limite l’utilisation de l’aluminium à des températures proches de 100°C), la résistance relativement faible et les mauvaises propriétés de corrosion de l’aluminium le rendent inadapté comme matériau de structure.
Formes de corrosion
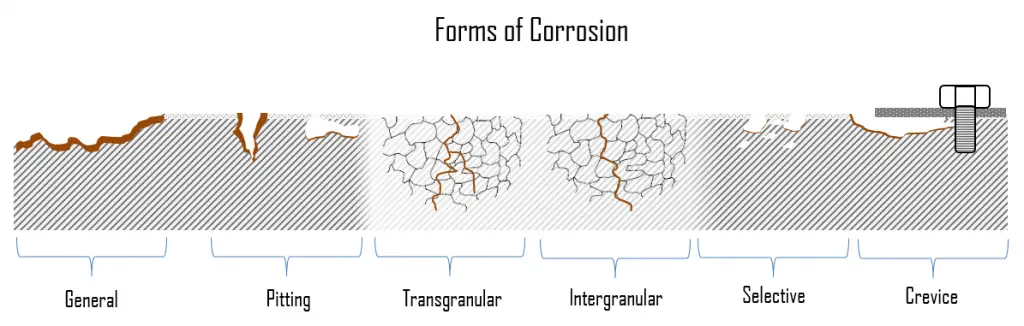
Lors de la corrosion des métaux, les zones sur lesquelles se produisent les réactions anodiques et cathodiques peuvent varier considérablement. La corrosion peut prendre différentes formes et se développer à des rythmes différents. Il en résulte diverses formes de corrosion telles qu’une attaque uniforme, des piqûres et une corrosion caverneuse. Le problème est que de nombreuses formes de corrosion existent et chacune est causée par des raisons différentes et subit des mécanismes différents. De plus, chaque forme de corrosion a son propre mécanisme particulier, qui peut être assez complexe dans certains cas. Ceci est particulièrement problématique lorsque deux ou plusieurs types de corrosion se produisent simultanément.
Dans la section suivante, nous décrirons brièvement les formes de corrosion les plus courantes . Ils sont essentiellement divisés en deux sous-catégories: forme générale (uniforme) et forme localisée de corrosion.
- Corrosion générale. La corrosion générale, également connue sous le nom de corrosion uniforme, est une forme de corrosion qui affecte toute la surface du métal, tandis que d’autres formes affectent un endroit ou une partie spécifique. Ce type de corrosion est couramment observé dans les métaux purs qui sont métallurgiques et de composition homogène. C’est une réaction très lente qui est assez uniformément répartie sur toute la surface métallique exposée à toute circulation d’eau. Le fait qu’elle affecte une surface assez importante du métal la rend beaucoup plus facile à détecter, et donc beaucoup moins sévère qu’une corrosion localisée. Le problème de la corrosion générale est qu’elle entraîne un grand volume d’oxydes qui ont tendance à se fixer sur les surfaces de transfert de chaleur et à affecter l’efficacité du système.
- Corrosion localisée. Dans la corrosion localisée, il y a une attaque intense sur des sites localisés à la surface d’un composant tandis que le reste de la surface se corrode à un rythme beaucoup plus faible. La corrosion localisée se produit lorsque la corrosion fonctionne avec d’autres processus destructeurs tels que le stress, la fatigue, l’érosion et d’autres formes d’attaque chimique.
Corrosion générale
La corrosion générale, également connue sous le nom de corrosion uniforme, est une forme de corrosion qui affecte toute la surface du métal, tandis que d’autres formes affectent un endroit ou une partie spécifique. C’est la forme de corrosion la plus courante. Ce type de corrosion est couramment observé dans les métaux purs qui sont métallurgiques et de composition homogène. Les aciers patinables, les alliages de magnésium, les alliages de zinc et les alliages de cuivre sont des exemples de matériaux qui présentent généralement une corrosion générale. Les matériaux passifs, tels que les aciers inoxydables, les alliages d’aluminium ou les alliages nickel-chrome sont généralement sujets à une corrosion localisée.
C’est une réaction très lente qui est assez uniformément répartie sur toute la surface métallique exposée à toute circulation d’eau. Le fait qu’elle affecte une surface assez importante du métal la rend beaucoup plus facile à détecter, et donc beaucoup moins sévère qu’une corrosion localisée. Le problème de la corrosion générale est qu’elle entraîne un grand volume d’oxydes qui ont tendance à se fixer sur les surfaces de transfert de chaleur et à affecter l’efficacité du système.
Corrosion générale – Protection
Certaines méthodes standard associées à la sélection des matériaux qui protègent contre la corrosion générale comprennent:
- L’utilisation de matériaux résistants à la corrosion tels que l’acier inoxydable et les alliages de nickel, de chrome et de molybdène.
- L’utilisation de revêtements protecteurs tels que les peintures et les époxydes.
- L’application de revêtements ou de revêtements métalliques et non métalliques sur la surface qui protège contre la corrosion, mais permet au matériau de conserver sa résistance structurelle (par exemple, un récipient sous pression en acier au carbone avec un revêtement en acier inoxydable comme revêtement).
Corrosion localisée
Dans la corrosion localisée, il y a une attaque intense sur des sites localisés à la surface d’un composant tandis que le reste de la surface se corrode à un rythme beaucoup plus faible. La corrosion localisée se produit lorsque la corrosion fonctionne avec d’autres processus destructeurs tels que le stress, la fatigue, l’érosion et d’autres formes d’attaque chimique. Les mécanismes de corrosion localisés peuvent causer plus de dommages que n’importe lequel de ces processus destructeurs individuellement. La corrosion localisée peut être classée en corrosion par piqûres, corrosion galvanique, corrosion caverneuse, corrosion sélective, corrosion par érosion, corrosion intergranulaire, corrosion sous contrainte chlorée et fissuration par corrosion sous contrainte (SCC). Les matériaux passifs, tels que les aciers inoxydables, les alliages d’aluminium ou les alliages de nickel-chrome sont généralement sujets à une corrosion localisée.
Corrosion par piqûres
La piqûre, caractérisée par des trous bien définis, est l’une des formes de corrosion les plus insidieuses. Ils pénètrent ordinairement du haut d’une surface horizontale vers le bas dans une direction presque verticale. On suppose que la gravité fait pousser les fosses vers le bas. La corrosion par piqûres peut provoquer une défaillance par perforation tout en ne produisant qu’une faible perte de poids sur le métal. Cette perforation peut être difficile à détecter et sa croissance rapide, entraînant une perte de fonction inattendue du composant. La corrosion par piqûres a également été associée à la corrosion caverneuse et galvanique. Le dépôt de métal (ions de cuivre plaqués sur une surface en acier) peut également créer des sites d’attaque par piqûres.
Les causes de la corrosion par piqûres comprennent:
- Inhomogénéité locale sur la surface métallique
- Perte locale de passivité
- Rupture mécanique ou chimique d’un revêtement d’oxyde protecteur
- Corrosion galvanique d’une cathode relativement éloignée
Avec les alliages résistants à la corrosion, tels que les aciers inoxydables, la cause la plus fréquente de corrosion par piqûres est la destruction très localisée de la passivité par contact avec l’humidité qui contient des ions halogénures, en particulier des chlorures. Cependant, l’alliage avec environ 2% de molybdène améliore considérablement leur résistance. La piqûre induite par le chlorure des aciers inoxydables entraîne généralement une sous-cotation, produisant des cavités ou des cavernes souterraines agrandies.
Corrosion par piqûres – Protection
La corrosion par piqûres est un danger dû à la possible pénétration rapide du métal avec peu de perte globale de masse. La corrosion par piqûres est minimisée par:
- Éviter les conditions stagnantes
- Utiliser les bons métaux et alliages qui sont moins sensibles à la corrosion
- Éviter les agents dans le milieu qui provoquent des piqûres
- Concevoir le système et les composants de sorte qu’aucune crevasse ne soit présente
Corrosion caverneuse
La corrosion caverneuse fait référence à la corrosion localisée qui se produit au niveau de la crevasse ou de l’espace entre deux ou plusieurs métaux d’assemblage. La corrosion caverneuse est un type de corrosion par piqûres qui se produit spécifiquement dans la région à faible débit d’une crevasse. Ce type d’attaque est généralement associé à de petits volumes de solution stagnante causés par des trous, la surface des joints, des joints à recouvrement, des dépôts de surface et des crevasses sous les têtes de boulons et de rivets. Les dommages ont lieu en raison de la différence de concentration des constituants, principalement l’oxygène, dans les surfaces concernées. La corrosion caverneuse peut progresser très rapidement (des dizaines à des centaines de fois plus vite que le taux normal de corrosion générale dans la même solution donnée).
La corrosion caverneuse est un danger dû à la possible pénétration rapide du métal avec une faible perte globale de masse. La corrosion caverneuse est minimisée par:
- La corrosion caverneuse peut être évitée en utilisant des joints soudés au lieu de joints rivetés ou boulonnés
- Utiliser les bons métaux et alliages qui sont moins sensibles à la corrosion
- Éviter les agents dans le milieu qui provoquent des piqûres
- Concevoir le système et les composants de sorte qu’aucune crevasse ne soit présente
Corrosion galvanique
La corrosion galvanique se produit lorsque deux métaux différents sont immergés dans une solution conductrice en présence d’une certaine différence de potentiel et qu’il y a un flux d’électrons entre les métaux. Cela peut également avoir lieu avec un métal avec des hétérogénéités (dissimilarités) (par exemple, des inclusions d’impuretés, des grains de tailles différentes, une différence de composition des grains ou des différences de contraintes mécaniques). Le métal moins résistant à la corrosion devient anode et le métal plus résistant à la corrosion devient cathode. La corrosion de la résistance la moins corrosive est généralement augmentée et l’attaque sur le matériau plus résistant est diminuée. Une différence de potentiel électrique existe entre les différents métaux et sert de force motrice pour la circulation du courant électrique à travers le corrodant ou l’électrolyte.
La corrosion galvanique ne se produit que si les conditions suivantes sont remplies:
- Deux métaux différents doivent être présents
- Les deux métaux doivent être en contact, ou un chemin électriquement conducteur entre les deux doit être présent
- Il doit y avoir un chemin électriquement conducteur pour que les ions se déplacent de « l’anode » à la « cathode »
Si l’une de ces conditions n’est pas satisfaite, il est peu probable qu’une corrosion galvanique se produise.
La corrosion galvanique ne provoque la détérioration que d’un seul des métaux. Le plus fort, le plus noble est cathodique (positif) et protégé. C’est le mécanisme des anodes galvaniques, qui sont le composant principal d’un système de protection cathodique galvanique (CP) utilisé pour protéger les structures métalliques enterrées ou immergées de la corrosion. Dans certains cas, la corrosion galvanique peut être utile.
Lixiviation sélective – Corrosion sélective
La lixiviation sélective ou la corrosion sélective est l’élimination d’un élément d’un alliage solide par un processus de corrosion. L’exemple le plus courant est la dézincification du laiton, dans laquelle le zinc est lixivié sélectivement à partir d’un alliage de laiton cuivre-zinc. Ce processus produit une structure de cuivre poreuse affaiblie. L’élimination sélective du zinc peut se faire de manière uniforme ou à une échelle localisée.
Cependant, de nombreux alliages sont soumis à une lixiviation sélective sous certaines conditions. Un processus similaire se produit dans d’autres systèmes d’alliages dans lesquels l’aluminium, le fer, le cobalt, le chrome et d’autres éléments sont éliminés. Les éléments en alliage plus résistants à l’environnement restent en retrait. Deux mécanismes sont impliqués :
- Deux métaux dans un alliage sont dissous ; un métal se redépose à la surface des éléments survivants.
- Un métal est sélectivement dissous, laissant les autres métaux derrière lui.
Le premier système est impliqué dans la dézincification des laitons, et le second système est impliqué lorsque le molybdène est éliminé des alliages de nickel dans de l’hydroxyde de sodium fondu.
Érosion Corrosion
La corrosion par érosion est le dommage cumulatif induit par les réactions de corrosion électrochimique et les effets mécaniques du mouvement relatif entre l’électrolyte et la surface de corrosion. L’érosion peut également se produire en combinaison avec d’autres formes de dégradation, telles que la corrosion. On parle alors d’érosion-corrosion. La corrosion par érosion est un processus de dégradation des matériaux dû à l’effet combiné de la corrosion et de l’usure. Presque tous les fluides corrosifs fluides ou turbulents peuvent provoquer une corrosion par érosion. Le mécanisme peut être décrit comme suit:
- érosion mécanique du matériau, ou couche d’oxyde protectrice (ou passive) à sa surface,
- corrosion accrue du matériau, si la vitesse de corrosion du matériau dépend de l’épaisseur de la couche d’oxyde.
La corrosion par érosion se trouve dans les systèmes tels que la tuyauterie, les vannes, les pompes, les buses, les échangeurs de chaleur et les turbines. L’usure est un processus de dégradation mécanique des matériaux qui se produit sur les surfaces de frottement ou d’impact, tandis que la corrosion implique des réactions chimiques ou électrochimiques du matériau. La corrosion peut accélérer l’usure et l’usure peut accélérer la corrosion.
Corrosion intergranulaire – dégradation des soudures
La corrosion intergranulaire (IGC) est une corrosion préférentielle le long des joints de grains d’un matériau. pour certains alliages et dans des environnements spécifiques. Ce type de corrosion est particulièrement répandu dans certains aciers inoxydables. Dans les aciers inoxydables, la corrosion intergranulaire peut se produire suite à la précipitation de carbures de chrome (Cr23C6) ou de phases intermétalliques.
La résistance de ces alliages métalliques aux effets chimiques des agents corrosifs repose sur la passivation. Pour que la passivation se produise et reste stable, l’ alliage Fe-Cr doit avoir une teneur minimale en chrome d’environ 10,5 % en poids, au-dessus de laquelle la passivation peut se produire et en dessous de laquelle elle est impossible. Mais les carbures de chrome peuvent précipiter dans les joints de grains, ce qui entraîne un appauvrissement en chrome dans les zones proches des joints de grains en raison de la vitesse de diffusion du chrome qui est lente. Les zones appauvries en chrome deviennent moins résistantes à la corrosion que le reste de la matrice. Dans un environnement corrosif, les zones appauvries peuvent être activées et la corrosion se produira dans des zones très étroites entre les grains.
La corrosion intergranulaire est un problème particulièrement grave dans le soudage des aciers inoxydables, lorsqu’elle est souvent appelée dégradation de la soudure. Également un acier inoxydable, qui a été traité thermiquement d’une manière qui produit des précipités aux joints de grains et des zones appauvries en chrome adjacentes, il est sensibilisé. Les aciers inoxydables peuvent être stabilisés contre ce comportement par addition de titane, de niobium ou de tantale, qui forment du carbure de titane, du carbure de niobium et du carbure de tantale préférentiellement au carbure de chrome, en abaissant la teneur en carbone de l’acier et en cas de soudage également dans le métal d’apport inférieur à 0,02 %, soit en chauffant l’ensemble de la pièce au-dessus de 1000 °C et en la trempent dans l’eau, entraînant la dissolution du carbure de chrome dans les grains et empêchant alors sa précipitation.
Il existe deux cas particuliers de corrosion intergranulaire, mais ces mécanismes sont traités séparément:
- Fissuration par corrosion. La corrosion intergranulaire induite par les contraintes environnementales est appelée fissuration par corrosion sous contrainte.
- Fissuration par corrosion sous contrainte chlorure. La corrosion intergranulaire induite par l’action combinée des contraintes environnementales et du chlore est appelée fissuration par corrosion sous contrainte chlorure.
Fissuration par corrosion sous contrainte – SCC
L’un des problèmes métallurgiques les plus graves et une préoccupation majeure dans l’industrie nucléaire est la fissuration par corrosion sous contrainte (SCC). La fissuration par corrosion sous contrainte résulte de l’ action combinée d’une contrainte de traction appliquée et d’un environnement corrosif, les deux influences sont nécessaires. La SCC est un type de corrosion par attaque intergranulaire qui se produit aux joints de grains sous contrainte de traction. Il a tendance à se propager lorsque la contrainte ouvre des fissures sujettes à la corrosion, qui sont ensuite corrodées davantage, affaiblissant le métal en se fissurant davantage. Les fissures peuvent suivre des chemins intergranulaires ou transgranulaires, et il y a souvent une tendance à la ramification des fissures. Le comportement à la rupture est caractéristique de celui d’un matériau fragile, même si l’alliage métallique est intrinsèquement ductile. Le SCC peut entraîner une défaillance soudaine et inattendue d’alliages métalliques normalement ductiles soumis à une contrainte de traction, en particulier à température élevée. Le SCC est chimiquement très spécifique en ce sens que certains alliages sont susceptibles de subir un SCC uniquement lorsqu’ils sont exposés à un petit nombre d’environnements chimiques.
Voir aussi: fissuration par corrosion sous contrainte
Les moyens les plus efficaces de prévenir le SCC dans les systèmes de réacteur sont:
- concevoir correctement
- réduire le stress
- éliminer les espèces environnementales critiques telles que les hydroxydes, les chlorures et l’oxygène
- éviter les zones stagnantes et les crevasses dans les échangeurs de chaleur où le chlorure et l’hydroxyde pourraient se concentrer.
Fissuration par corrosion sous contrainte de chlorure
La corrosion sous contrainte chlorure se produit dans les aciers inoxydables austénitiques sous contrainte de traction en présence d’oxygène, d’ions chlorure et à haute température. C’est l’une des formes les plus importantes de corrosion sous contrainte qui concerne l’industrie nucléaire. Les aciers inoxydables austénitiques contiennent entre 16 et 25 % de Cr et peuvent également contenir de l’azote en solution, ce qui contribue à leur résistance à la corrosion uniforme relativement élevée. Un type de corrosion qui peut attaquer l’acier inoxydable austénitique est la corrosion sous contrainte chlorée.
Les trois conditions qui doivent être présentes pour que la corrosion sous contrainte par le chlorure se produise sont les suivantes:
- Les ions chlorure sont présents dans l’environnement
- L’oxygène dissous est présent dans l’environnement
- Le métal est soumis à une contrainte de traction
La corrosion sous contrainte par les chlorures implique une attaque sélective du métal le long des joints de grains. La résistance de ces alliages métalliques aux effets chimiques des agents corrosifs repose sur la passivation. Pour que la passivation se produise et reste stable, l’ alliage Fe-Cr doit avoir une teneur minimale en chrome d’environ 10,5 % en poids, au-dessus duquel la passivité peut se produire et en-dessous duquel elle est impossible. Mais les carbures de chrome peuvent précipiter dans les joints de grains, ce qui entraîne un appauvrissement en chrome dans les zones proches des joints de grains en raison de la vitesse de diffusion du chrome qui est lente. Les zones appauvries en chrome deviennent moins résistantes à la corrosion que le reste de la matrice. Dans un environnement corrosif, les zones appauvries peuvent être activées et la corrosion se produira dans des zones très étroites entre les grains.
Il a été constaté que cela est étroitement lié à certains traitements thermiques résultant du soudage. Cela peut être considérablement minimisé par des processus de recuit appropriés. Cette forme de corrosion est contrôlée en maintenant une faible teneur en ions chlorure et en oxygène dans l’environnement et en utilisant des aciers à faible teneur en carbone. Les aciers inoxydables ferritiques sont choisis pour leur résistance à la fissuration par corrosion sous contrainte, ce qui en fait une alternative attrayante aux aciers inoxydables austénitiques dans les applications où la SCC induite par les chlorures est répandue.
Protection contre la corrosion
Comme cela a été écrit, le problème de la corrosion métallique est important. En termes économiques, on a estimé qu’environ 5 % des revenus d’un pays industrialisé sont consacrés à la prévention de la corrosion et à l’entretien ou au remplacement des produits perdus ou contaminés à la suite de réactions de corrosion. Par conséquent, divers traitements sont utilisés pour ralentir les dommages par corrosion des objets métalliques exposés aux intempéries, à l’eau salée, aux acides ou à d’autres environnements hostiles. Puisqu’il existe de nombreuses formes de corrosion, il existe de nombreuses façons d’arrêter ou d’atténuer la corrosion. Dans tous les cas, cela dépend du matériau à protéger et aussi de l’environnement dans lequel le matériau est utilisé. Les métaux peuvent être protégés de la corrosion en utilisant un métal dans un environnement dans lequel il est immunisé, en réalisant une barrière physique entre le métal et son environnement,
- Sélection des matériaux. Le moyen le plus courant et le plus simple de prévenir la corrosion consiste peut-être à sélectionner judicieusement les matériaux une fois que l’environnement de corrosion a été caractérisé. Certains métaux et alliages ferreux et de nombreux non ferreux sont largement utilisés dans les environnements corrosifs. Dans tous les cas, cela dépend fortement de certains environnements et d’autres conditions. Ici, le coût peut être un facteur important. Il n’est pas toujours économiquement faisable d’employer le matériau qui offre la résistance optimale à la corrosion.
- Traitement de surface anti-corrosion. Un revêtement assure une protection en formant une barrière physique entre le substrat métallique et un environnement corrosif aqueux. Les revêtements protègent les structures métalliques de la corrosion par des effets d’inhibition et de barrière. L’effet barrière dépend de l’adhérence à la sous-couche mais aussi des propriétés non conductrices du revêtement. La pénétration d’eau ou d’ions est une cause majeure de perte de la barrière, ce qui peut entraîner un délaminage du revêtement et une corrosion sous le film. Le placage, la peinture et l’application d’émail sont les traitements anticorrosion les plus courants.
- Anodisation. L’anodisation est un procédé de passivation électrolytique utilisé pour augmenter l’épaisseur de la couche d’oxyde naturel à la surface des pièces métalliques. Un nombre limité de métaux, tels que les aciers inoxydables, peuvent atteindre la passivité. Le processus est appelé anodisation car la pièce à traiter forme l’électrode anodique d’une cellule électrolytique. Les alliages d’aluminium sont généralement anodisés pour augmenter la résistance à la corrosion et pour permettre la teinture (coloration).
- Protection cathodique. La protection cathodique est une protection très efficace contre la corrosion basée sur l’utilisation d’un matériau plus anodique que le métal à protéger. Le métal protégé est relié électriquement à un autre métal qui est plus réactif dans l’environnement particulier. Le métal moins résistant à la corrosion devient anode et le métal plus résistant à la corrosion devient cathode. La corrosion de la résistance la moins corrosive est généralement augmentée et l’attaque sur le matériau plus résistant est diminuée. Une différence de potentiel électrique existe entre les différents métaux et sert de force motrice pour la circulation du courant électrique à travers le corrodant ou l’électrolyte. Les systèmes de protection cathodique sont le plus souvent utilisés pour protéger les structures métalliques enterrées ou submergées de la corrosion, telles que les pipelines et les réservoirs en acier. Magnésium, zinc, et les alliages d’aluminium sont des anodes sacrificielles courantes. Les anodes en magnésium sont le plus souvent utilisées pour les applications de sols enfouis. Le zinc est le plus souvent utilisé pour les applications marines d’eau douce et d’eau salée. Les alliages d’aluminium sont le plus souvent utilisés pour les structures offshore.
- Inhibiteurs de corrosion. Si l’environnement est contrôlé (en particulier dans les systèmes à recirculation), des inhibiteurs de corrosion peuvent souvent y être ajoutés. Ces produits chimiques forment un revêtement électriquement isolant ou chimiquement imperméable sur les surfaces métalliques exposées, pour supprimer les réactions électrochimiques. Les inhibiteurs de corrosion sont des produits chimiques qui, lorsqu’ils sont ajoutés à des concentrations relativement faibles dans l’environnement, réduisent la vitesse d’un processus corrosif. La substance qui agit comme inhibiteur dépend à la fois de l’environnement corrosif et de l’alliage. Les inhibiteurs sont normalement utilisés dans des systèmes fermés tels que les radiateurs automobiles et les chaudières à vapeur. Un exemple de ce principe est l’utilisation d’antigel dans les voitures. L’efficacité d’un inhibiteur dépend de plusieurs mécanismes différents. Certains réagissent avec les espèces chimiquement actives dans la solution tandis que d’autres réagissent avec la surface corrosive et interfèrent avec la réaction corrosive, ou forment un mince revêtement protecteur. Par exemple, l’oxygène est généralement éliminé par des inhibiteurs réducteurs tels que les amines et les hydrazines. Dans cet exemple, l’hydrazine convertit l’oxygène, un agent corrosif courant, en eau, ce qui est généralement bénin. De nombreux inhibiteurs sont également toxiques et ne conviennent donc pas à toutes les applications. Une autre limitation des inhibiteurs est qu’ils perdent généralement leur efficacité lorsque la température et la concentration de l’environnement augmentent. un agent corrosif commun, à l’eau, qui est généralement bénin. De nombreux inhibiteurs sont également toxiques et ne conviennent donc pas à toutes les applications. Une autre limitation des inhibiteurs est qu’ils perdent généralement leur efficacité lorsque la température et la concentration de l’environnement augmentent. un agent corrosif commun, à l’eau, qui est généralement bénin. De nombreux inhibiteurs sont également toxiques et ne conviennent donc pas à toutes les applications. Une autre limitation des inhibiteurs est qu’ils perdent généralement leur efficacité lorsque la température et la concentration de l’environnement augmentent.
Alliages résistants à la corrosion
Les alliages anticorrosion, comme leur nom l’indique, sont des alliages à résistance à la corrosion renforcée. Certains métaux et alliages ferreux et de nombreux non ferreux sont largement utilisés dans les environnements corrosifs. Dans tous les cas, cela dépend fortement de certains environnements et d’autres conditions. Les alliages résistants à la corrosion sont utilisés pour les canalisations d’eau et de nombreuses applications chimiques et industrielles. Dans le cas des alliages ferreux, on parle d’aciers inoxydables et dans une certaine mesure de fontes. Mais certains alliages non ferreux résistant à la corrosion présentent une résistance à la corrosion remarquable et peuvent donc être utilisés à de nombreuses fins spéciales. Il existe deux raisons principales pour lesquelles les matériaux non ferreux sont préférés aux aciers et aux aciers inoxydables pour bon nombre de ces applications. Par exemple, bon nombre des les métaux et alliages non ferreux possèdent une résistance à la corrosion beaucoup plus élevée que les aciers alliés et les nuances d’acier inoxydable disponibles. Deuxièmement, un rapport résistance/poids élevé ou une conductivité thermique et électrique élevée peut fournir un avantage distinct par rapport à un alliage ferreux.
CRUD dans les centrales électriques
En génie nucléaire, «CRUD» est un terme technique désignant les produits de corrosion et d’usure (particules de rouille, etc.) dans le caloporteur qui deviennent radioactifs lorsqu’ils sont exposés à des radiations. Le terme est en fait un acronyme pour les gisements non identifiés de Chalk River, trouvés à l’origine sur la gaine, ou le revêtement extérieur, des barres de combustible dans le réacteur canadien pour lequel il a été nommé. Le CRUD peut être défini comme des produits de corrosion circulants déposés ou en suspension, principalement des oxydes métalliques, formés par la réaction de l’eau avec les matériaux de la tuyauterie. Selon la CIPR, le CRUD formé dans les centrales électriques est la principale source d’exposition aux rayonnements des opérateurs.
Outre ces aspects radiologiques, les CRUD peuvent avoir un certain nombre d’effets néfastes sur la plante et ses composants. Ceux-ci peuvent inclure les éléments suivants:
- Encrassement mécanique des équipements.
- Augmentation de la perte de charge à travers le noyau
La centrale électrique doit être conçue pour minimiser la corrosion et les dépôts. Cette conception comprend l’élimination efficace des produits de corrosion, le système de purification, la conception et l’agencement de l’équipement pour minimiser le dépôt de saleté et la sélection de la chimie du liquide de refroidissement pour réduire la corrosion.
La science des matériaux:
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- González-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Corrosion , vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.