 A corrosão é a deterioração de um material devido à interação química com o meio ambiente. É um processo natural no qual os metais convertem sua estrutura em uma forma quimicamente mais estável, como óxidos, hidróxidos ou sulfetos. As consequências da corrosão são muito comuns. Exemplos familiares incluem a ferrugem de painéis e tubulações de carrocerias automotivas e muitas ferramentas. A corrosão é geralmente um fenômeno negativo, pois está associada à falha mecânica de um objeto. Átomos de metal são removidos de um elemento estrutural até que ele falhe, ou óxidos se acumulam dentro de um tubo até que seja entupido. Todos os metais e ligas estão sujeitos à corrosão. Mesmo os metais nobres, como o ouro, estão sujeitos ao ataque corrosivo em alguns ambientes.
A corrosão é a deterioração de um material devido à interação química com o meio ambiente. É um processo natural no qual os metais convertem sua estrutura em uma forma quimicamente mais estável, como óxidos, hidróxidos ou sulfetos. As consequências da corrosão são muito comuns. Exemplos familiares incluem a ferrugem de painéis e tubulações de carrocerias automotivas e muitas ferramentas. A corrosão é geralmente um fenômeno negativo, pois está associada à falha mecânica de um objeto. Átomos de metal são removidos de um elemento estrutural até que ele falhe, ou óxidos se acumulam dentro de um tubo até que seja entupido. Todos os metais e ligas estão sujeitos à corrosão. Mesmo os metais nobres, como o ouro, estão sujeitos ao ataque corrosivo em alguns ambientes.
A maioria dos metais não é termodinamicamente estável na forma metálica; eles querem corroer e reverter para as formas mais estáveis que normalmente são encontradas em minérios, como óxidos. A corrosão também pode ocorrer em outros materiais que não os metais, como cerâmicas ou polímeros, embora neste contexto o termo “degradação” seja mais comum. Os materiais cerâmicos são relativamente resistentes à deterioração, que geralmente ocorre em temperaturas elevadas ou em ambientes bastante extremos. O processo é freqüentemente também chamado de corrosão. Para polímeros, os mecanismos e consequências diferem daqueles para metais e cerâmicas, e o termo degradação é usado com mais frequência. A corrosão degrada as propriedades úteis de materiais e estruturas, incluindo resistência, aparência e permeabilidade a líquidos e gases.
A corrosão é de natureza eletroquímica porque as reações químicas corrosivas envolvem uma transferência de carga. A química da corrosão é bastante complexa, mas pode ser considerada essencialmente como um fenômeno eletroquímico. Os íons metálicos entram em solução fazendo com que o metal fique carregado negativamente em relação ao eletrólito. A diferença na carga causa o desenvolvimento de um potencial e produz uma voltagem entre o eletrólito e o metal.
A corrosão, como um processo natural e persistente, também envolve a deterioração não intencional de metais, às vezes com resultados desastrosos. Qual é o tamanho do problema de corrosão? O problema da corrosão metálica é significativo. Em termos econômicos, estima-se que aproximadamente 5% da renda de uma nação industrializada é gasta na prevenção da corrosão e na manutenção ou substituição de produtos perdidos ou contaminados como resultado de reações de corrosão.
A corrosão é a principal preocupação em usinas de reatores nucleares. A corrosão ocorre continuamente em toda a planta do reator e todo metal está sujeito a ela. Embora essa corrosão não possa ser eliminada, ela pode ser controlada.
Passivação
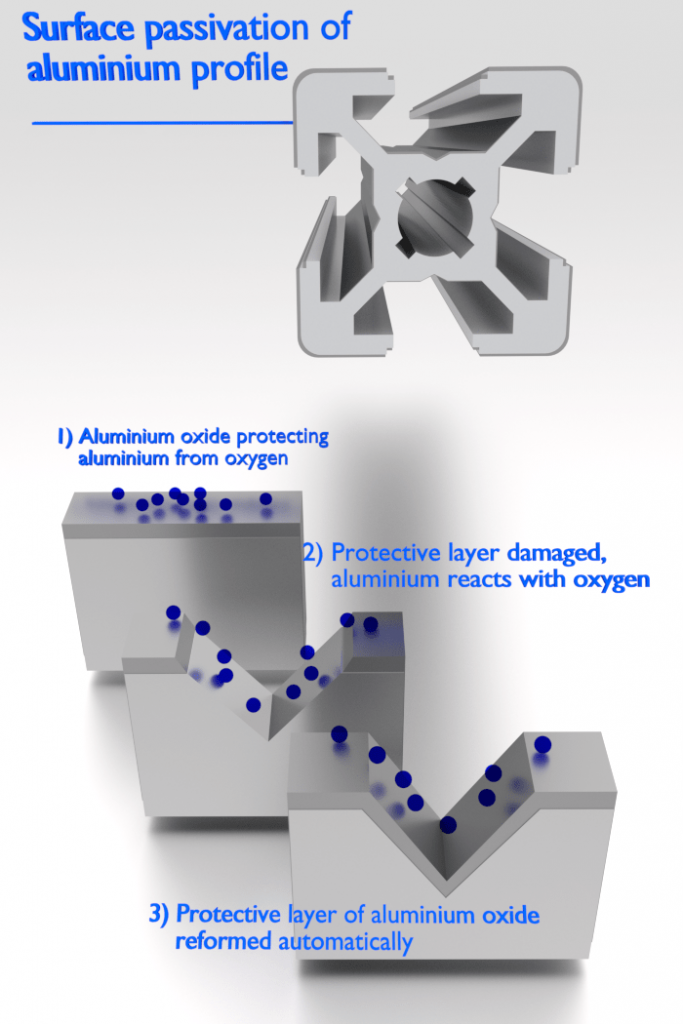 Existem metais, que apresentam uma passividade à corrosão. A passividade é a característica de um metal exibida quando esse metal não se torna ativo na reação de corrosão. A passivação é um processo natural de formação de uma camada estável e tenaz de óxido metálico ou barreira protetora na superfície do metal que atua como uma barreira separando a superfície do metal do meio ambiente. A passividade diminui ou interrompe o processo de corrosão devido à formação da camada. Felizmente, do ponto de vista da engenharia, os metais mais suscetíveis a esse tipo de comportamento são os materiais estruturais e de engenharia comuns, incluindo ferro, níquel, silício, cromo, titânio e ligas contendo esses metais.
Existem metais, que apresentam uma passividade à corrosão. A passividade é a característica de um metal exibida quando esse metal não se torna ativo na reação de corrosão. A passivação é um processo natural de formação de uma camada estável e tenaz de óxido metálico ou barreira protetora na superfície do metal que atua como uma barreira separando a superfície do metal do meio ambiente. A passividade diminui ou interrompe o processo de corrosão devido à formação da camada. Felizmente, do ponto de vista da engenharia, os metais mais suscetíveis a esse tipo de comportamento são os materiais estruturais e de engenharia comuns, incluindo ferro, níquel, silício, cromo, titânio e ligas contendo esses metais.
Por exemplo, o aço inoxidável deve suas propriedades de resistência à corrosão à formação de um filme superficial passivo auto-reparador. Para que a passivação ocorra e permaneça estável, a liga Fe-Cr deve ter um teor mínimo de cromo de cerca de 10,5% em peso, acima do qual a passividade pode ocorrer e abaixo do qual é impossível. Uma vez que a superfície é limpa e a composição a granel do aço inoxidável é exposta ao ar, o filme passivo se forma imediatamente.
O alumínio é altamente resistente à corrosão em muitos ambientes porque também passiva. Se danificada, a película protetora normalmente se reconstitui muito rapidamente. No entanto, uma mudança no caráter do ambiente (por exemplo, alteração na concentração das espécies corrosivas ativas) pode fazer com que um material passivado volte a um estado ativo. Geralmente, em altas temperaturas (na água, a corrosão limita o uso de alumínio a temperaturas próximas a 100°C), a relativa baixa resistência e as fracas propriedades de corrosão do alumínio o tornam inadequado como material estrutural.
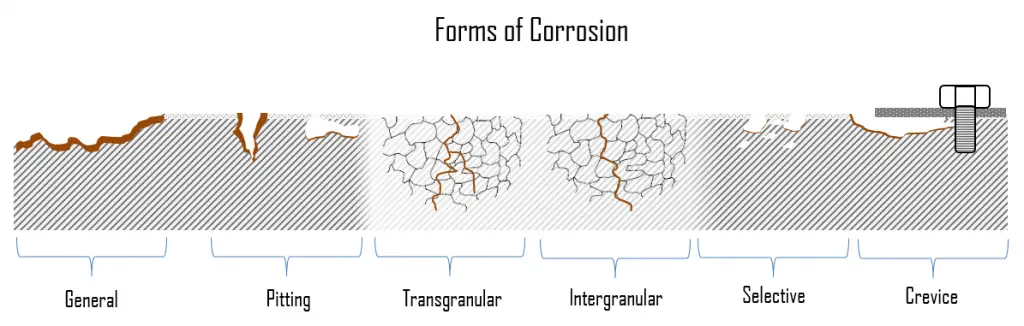
Formas de Corrosão
Durante a corrosão do metal, as áreas nas quais ocorrem as reações anódicas e catódicas podem variar muito. A corrosão pode vir em diferentes formas e crescer em taxas diferentes. Isso resulta em várias formas de corrosão, como ataque uniforme, pite e corrosão em frestas. O problema é que existem muitas formas de corrosão e cada uma é causada por motivos diferentes e sofre mecanismos diferentes. Além disso, cada forma de corrosão tem seu próprio mecanismo especial, que pode ser bastante complexo em alguns casos. Isso é especialmente problemático quando dois ou mais tipos de corrosão ocorrem simultaneamente.
Na seção seguinte, descreveremos brevemente as formas mais comuns de corrosão . Eles são basicamente divididos em duas subcategorias: forma geral (uniforme) e localizada de corrosão.
- Corrosão Geral. A corrosão geral, também conhecida como corrosão uniforme, é uma forma de corrosão que afeta toda a superfície do metal, enquanto outras formas afetam um ponto ou porção específica. Este tipo de corrosão é comumente observado em metais puros que são metalúrgicos e com composição uniforme. É uma reação muito lenta que é distribuída uniformemente por toda a superfície metálica exposta a qualquer água circulante. O fato de afetar uma área razoavelmente grande do metal torna muito mais fácil de detectar e, portanto, muito menos grave do que a corrosão localizada. O problema da corrosão geral é que ela resulta em um grande volume de óxidos que tendem a se ligar às superfícies de transferência de calor e afetam a eficiência do sistema.
- Corrosão localizada. Na corrosão localizada, há um ataque intenso em locais localizados na superfície de um componente, enquanto o restante da superfície está corroendo a uma taxa muito menor. A corrosão localizada ocorre quando a corrosão trabalha com outros processos destrutivos, como estresse, fadiga, erosão e outras formas de ataque químico.
Corrosão Geral
A corrosão geral, também conhecida como corrosão uniforme, é uma forma de corrosão que afeta toda a superfície do metal, enquanto outras formas afetam um ponto ou porção específica. É a forma mais comum de corrosão. Este tipo de corrosão é comumente observado em metais puros que são metalúrgicos e com composição uniforme. Aços resistentes, ligas de magnésio, ligas de zinco e ligas de cobre são exemplos de materiais que normalmente exibem corrosão geral. Materiais passivos, como aços inoxidáveis, ligas de alumínio ou ligas de níquel-cromo geralmente estão sujeitos à corrosão localizada.
É uma reação muito lenta que é distribuída uniformemente por toda a superfície metálica exposta a qualquer água circulante. O fato de afetar uma área razoavelmente grande do metal torna muito mais fácil de detectar e, portanto, muito menos grave do que a corrosão localizada. O problema da corrosão geral é que ela resulta em um grande volume de óxidos que tendem a se ligar às superfícies de transferência de calor e afetam a eficiência do sistema.
Corrosão Geral – Proteção
Alguns métodos padrão associados à seleção de materiais que protegem contra a corrosão geral incluem:
- O uso de materiais resistentes à corrosão, como aço inoxidável e ligas de níquel, cromo e molibdênio.
- O uso de revestimentos protetores, como tintas e epóxis.
- A aplicação de revestimentos ou revestimentos metálicos e não metálicos na superfície que protege contra a corrosão, mas permite que o material retenha sua resistência estrutural (por exemplo, um vaso de pressão de aço carbono com revestimento de aço inoxidável como revestimento).
Corrosão Localizada
Na corrosão localizada, há um ataque intenso em locais localizados na superfície de um componente, enquanto o restante da superfície está corroendo a uma taxa muito menor. A corrosão localizada ocorre quando a corrosão trabalha com outros processos destrutivos, como estresse, fadiga, erosão e outras formas de ataque químico. Mecanismos de corrosão localizados podem causar mais danos do que qualquer um desses processos destrutivos individualmente. A corrosão localizada pode ainda ser classificada como corrosão por pitting, corrosão galvânica, corrosão por frestas, corrosão seletiva, corrosão por erosão, corrosão intergranular, corrosão sob tensão de cloreto e fissuração por corrosão sob tensão (SCC). Materiais passivos, como aços inoxidáveis, ligas de alumínio ou ligas de níquel-cromo geralmente estão sujeitos à corrosão localizada.
Corrosão localizada
O pitting, caracterizado por orifícios nitidamente definidos, é uma das formas mais insidiosas de corrosão. Eles geralmente penetram do topo de uma superfície horizontal para baixo em uma direção quase vertical. Supõe-se que a gravidade faz com que os poços cresçam para baixo. A corrosão por pite pode causar falha por perfuração enquanto produz apenas uma pequena perda de peso no metal. Esta perfuração pode ser difícil de detectar e seu crescimento rápido, levando à perda inesperada de função do componente. A corrosão por pites também tem sido associada tanto à corrosão por frestas quanto à corrosão galvânica. A deposição de metal (íons de cobre depositados em uma superfície de aço) também pode criar locais para ataque por pite.
Causas de corrosão por pite incluem:
- Inomogeneidade local na superfície do metal
- Perda local de passividade
- Ruptura mecânica ou química de um revestimento protetor de óxido
- Corrosão galvânica de um cátodo relativamente distante
Com ligas resistentes à corrosão, como aços inoxidáveis, a causa mais comum de corrosão por pites é a destruição altamente localizada da passividade pelo contato com a umidade que contém íons halogenetos, particularmente cloretos. No entanto, a liga com cerca de 2% de molibdênio aumenta significativamente sua resistência. A corrosão por pite induzida por cloreto de aços inoxidáveis geralmente resulta em subcotação, produzindo cavidades ou cavernas subsuperficiais ampliadas.
Corrosão por pite – proteção
A corrosão por pite é um perigo devido à possível penetração rápida do metal com pouca perda geral de massa. A corrosão por pites é minimizada por:
- Evitando condições estagnadas
- Usando os metais e ligas corretos que são menos suscetíveis à corrosão
- Evitando agentes no meio que causam corrosão
- Projetar o sistema e os componentes de forma que não haja fendas
Corrosão intersticial
A corrosão por fresta refere-se à corrosão localizada que ocorre na fresta ou lacuna entre dois ou mais metais de união. A corrosão por frestas é um tipo de corrosão por pite que ocorre especificamente na região de baixo fluxo de uma fresta. Esse tipo de ataque geralmente está associado a pequenos volumes de solução estagnada causados por furos, superfícies de gaxetas, juntas sobrepostas, depósitos superficiais e fendas sob as cabeças dos parafusos e rebites. O dano ocorre devido à diferença de concentração dos constituintes, principalmente oxigênio, nas superfícies envolvidas. A corrosão em frestas pode progredir muito rapidamente (dezenas a centenas de vezes mais rápido que a taxa normal de corrosão geral na mesma solução).
A corrosão em frestas é um perigo devido à possível penetração rápida do metal com pouca perda geral de massa. A corrosão em frestas é minimizada por:
- A corrosão em frestas pode ser evitada usando juntas soldadas em vez de juntas rebitadas ou aparafusadas
- Usando os metais e ligas corretos que são menos suscetíveis à corrosão
- Evitando agentes no meio que causam corrosão
- Projetar o sistema e os componentes de forma que não haja fendas
Corrosão galvânica
A corrosão galvânica ocorre quando dois metais diferentes são imersos em uma solução condutora na presença de alguma diferença de potencial e há um fluxo de elétrons entre os metais. Também pode ocorrer com um metal com heterogeneidades (dissemelhanças) (por exemplo, inclusões de impurezas, grãos de tamanhos diferentes, diferença na composição dos grãos ou diferenças no estresse mecânico). O metal menos resistente à corrosão torna-se ânodo e o metal com maior resistência à corrosão torna-se cátodo. A corrosão da resistência menos corrosiva geralmente é aumentada e o ataque em material mais resistente é diminuído. Existe uma diferença no potencial elétrico entre os diferentes metais e serve como força motriz para o fluxo de corrente elétrica através do corrosivo ou eletrólito.
A corrosão galvânica ocorre somente se as seguintes condições forem atendidas:
- Dois metais diferentes devem estar presentes
- Os dois metais devem estar em contato, ou um caminho eletricamente condutor entre os dois deve estar presente
- Deve haver um caminho eletricamente condutivo para que os íons se movam do “ânodo” para o “cátodo”
Se alguma dessas condições não for satisfeita, não é provável que ocorra corrosão galvânica.
A corrosão galvânica causa apenas a deterioração de um dos metais. O mais forte, mais nobre é catódico (positivo) e protegido. Este é o mecanismo dos ânodos galvânicos, que são o principal componente de um sistema de proteção catódica galvânica (CP) usado para proteger estruturas metálicas enterradas ou submersas da corrosão. Em alguns casos, a corrosão galvânica pode ser útil.
Lixiviação Seletiva – Corrosão Seletiva
A lixiviação seletiva ou corrosão seletiva é a remoção de um elemento de uma liga sólida pelo processo de corrosão. O exemplo mais comum é a dezincificação do latão, na qual o zinco é lixiviado seletivamente de uma liga de latão cobre-zinco. Este processo produz uma estrutura de cobre porosa enfraquecida. A remoção seletiva do zinco pode ser de forma uniforme ou em escala localizada.
No entanto, muitas ligas estão sujeitas à lixiviação seletiva sob certas condições. Processo semelhante ocorre em outros sistemas de ligas nos quais alumínio, ferro, cobalto, cromo e outros elementos são removidos. Os elementos de uma liga mais resistentes ao meio ambiente ficam para trás. Dois mecanismos estão envolvidos:
- Dois metais em uma liga são dissolvidos; um metal se redeposita na superfície dos elementos sobreviventes.
- Um metal é dissolvido seletivamente, deixando os outros metais para trás.
O primeiro sistema está envolvido na dezincificação de latões, e o segundo sistema está envolvido quando o molibdênio é removido de ligas de níquel em hidróxido de sódio fundido.
Erosão Corrosão
A corrosão por erosão é o dano cumulativo induzido por reações eletroquímicas de corrosão e efeitos mecânicos do movimento relativo entre o eletrólito e a superfície corroída. A erosão também pode ocorrer em combinação com outras formas de degradação, como a corrosão. Isso é conhecido como erosão-corrosão. A corrosão por erosão é um processo de degradação do material devido ao efeito combinado de corrosão e desgaste. Quase todos os meios corrosivos fluidos ou turbulentos podem causar corrosão por erosão. O mecanismo pode ser descrito da seguinte forma:
- erosão mecânica do material, ou camada protetora (ou passiva) de óxido em sua superfície,
- corrosão aumentada do material, se a taxa de corrosão do material depender da espessura da camada de óxido.
A corrosão por erosão é encontrada em sistemas como tubulações, válvulas, bombas, bicos, trocadores de calor e turbinas. O desgaste é um processo mecânico de degradação do material que ocorre em superfícies de fricção ou impacto, enquanto a corrosão envolve reações químicas ou eletroquímicas do material. A corrosão pode acelerar o desgaste e o desgaste pode acelerar a corrosão.
Corrosão Intergranular – Decaimento da Solda
A corrosão intergranular (IGC) é a corrosão preferencial ao longo dos limites de grão de um material. para algumas ligas e em ambientes específicos. Este tipo de corrosão é especialmente prevalente em alguns aços inoxidáveis. Nos aços inoxidáveis, a corrosão intergranular pode ocorrer como conseqüência da precipitação de carbonetos de cromo (Cr23C6) ou de fases intermetálicas.
A resistência dessas ligas metálicas aos efeitos químicos dos agentes corrosivos é baseada na passivação. Para que a passivação ocorra e permaneça estável, a liga Fe-Cr deve ter um teor mínimo de cromo de cerca de 10,5% em peso, acima do qual a passividade pode ocorrer e abaixo do qual é impossível. Mas os carbonetos de cromo podem precipitar nos contornos de grão, o que resulta em esgotamento de cromo nas zonas próximas aos contornos de grão devido à taxa de difusão do cromo que é lenta. As zonas empobrecidas de cromo tornam-se menos resistentes à corrosão do que o resto da matriz. Em um ambiente corrosivo, as áreas esgotadas podem ser ativadas e a corrosão ocorrerá em áreas muito estreitas entre os grãos.
A corrosão intergranular é um problema especialmente grave na soldagem de aços inoxidáveis, quando muitas vezes é chamada de deterioração da solda. Também um aço inoxidável, que foi tratado termicamente de forma a produzir precipitados nos contornos de grão e zonas adjacentes depletadas de cromo, é sensibilizado. Os aços inoxidáveis podem ser estabilizados contra esse comportamento pela adição de titânio, nióbio ou tântalo, que formam carboneto de titânio, carboneto de nióbio e carboneto de tântalo preferencialmente ao carboneto de cromo, diminuindo o teor de carbono no aço e no caso de soldagem também no metal de adição abaixo de 0,02%, ou aquecendo toda a peça acima de 1000 °C e temperando-a em água, levando à dissolução do carboneto de cromo nos grãos e impedindo sua precipitação.
Existem dois casos especiais de corrosão intergranular, mas esses mecanismos são tratados separadamente:
- Corrosão sob tensão. A corrosão intergranular induzida por tensões ambientais é denominada corrosão sob tensão.
- Corrosão sob tensão por cloreto. A corrosão intergranular induzida pela ação combinada de tensões ambientais e cloro é chamada de corrosão sob tensão de cloreto.
Rachadura por Corrosão sob Tensão – SCC
Um dos problemas metalúrgicos mais sérios e que é uma grande preocupação na indústria nuclear é o cracking por corrosão sob tensão (SCC). A trinca por corrosão sob tensão resulta da ação combinada de uma tensão de tração aplicada e um ambiente corrosivo, ambas as influências são necessárias. SCC é um tipo de ataque corrosivo intergranular que ocorre nos contornos de grão sob tensão de tração. Ele tende a se propagar à medida que o estresse abre rachaduras sujeitas à corrosão, que são corroídas ainda mais, enfraquecendo o metal por novas rachaduras. As trincas podem seguir caminhos intergranulares ou transgranulares, e muitas vezes há uma tendência à ramificação da trinca. O comportamento de falha é característico de um material frágil, mesmo que a liga metálica seja intrinsecamente dúctil. O SCC pode levar a uma falha repentina inesperada de ligas metálicas normalmente dúcteis submetidas a uma tensão de tração, especialmente em temperaturas elevadas. O SCC é altamente específico quimicamente, pois certas ligas provavelmente sofrerão SCC apenas quando expostas a um pequeno número de ambientes químicos.
Veja também: Rachaduras por Corrosão sob Tensão
Os meios mais eficazes de prevenir SCC em sistemas de reatores são:
- projetando corretamente
- reduzindo o estresse
- removendo espécies ambientais críticas, como hidróxidos, cloretos e oxigênio
- evitando áreas estagnadas e fendas em trocadores de calor onde cloreto e hidróxido podem se concentrar.
Rachadura por Corrosão sob Tensão por Cloreto
A corrosão sob tensão por cloreto ocorre em aços inoxidáveis austeníticos sob tensão de tração na presença de oxigênio, íons cloreto e alta temperatura. É uma das formas mais importantes de corrosão sob tensão que preocupa a indústria nuclear. Os aços inoxidáveis austeníticos contêm entre 16 e 25% de Cr e também podem conter nitrogênio em solução, ambos os quais contribuem para sua resistência uniforme à corrosão relativamente alta. Um tipo de corrosão que pode atacar o aço inoxidável austenítico é a corrosão por tensão de cloreto.
As três condições que devem estar presentes para que ocorra a corrosão sob tensão por cloretos são as seguintes:
- Os íons cloreto estão presentes no ambiente
- Oxigênio dissolvido está presente no ambiente
- O metal está sob tensão de tração
A corrosão sob tensão por cloreto envolve um ataque seletivo do metal ao longo dos contornos de grão. A resistência dessas ligas metálicas aos efeitos químicos dos agentes corrosivos é baseada na passivação. Para que a passivação ocorra e permaneça estável, a liga Fe-Cr deve ter um teor mínimo de cromo de cerca de 10,5% em peso, acima do qual a passividade pode ocorrer e abaixo do qual é impossível. Mas os carbonetos de cromo podem precipitar nos contornos de grão, o que resulta em esgotamento de cromo nas zonas próximas aos contornos de grão devido à taxa de difusão do cromo que é lenta. As zonas empobrecidas de cromo tornam-se menos resistentes à corrosão do que o resto da matriz. Em um ambiente corrosivo, as áreas esgotadas podem ser ativadas e a corrosão ocorrerá em áreas muito estreitas entre os grãos.
Verificou-se que isso está intimamente associado a certos tratamentos térmicos resultantes da soldagem. Isso pode ser minimizado consideravelmente por processos de recozimento adequados. Essa forma de corrosão é controlada pela manutenção de baixo teor de íons cloreto e oxigênio no ambiente e pelo uso de aços com baixo teor de carbono. Os aços inoxidáveis ferríticos são escolhidos por sua resistência à corrosão sob tensão, o que os torna uma alternativa atraente aos aços inoxidáveis austeníticos em aplicações onde a SCC induzida por cloreto é predominante.
Proteção contra corrosão
Como foi escrito, o problema da corrosão metálica é significativo. Em termos econômicos, estima-se que aproximadamente 5% da renda de uma nação industrializada é gasta na prevenção da corrosão e na manutenção ou substituição de produtos perdidos ou contaminados como resultado de reações de corrosão. Portanto, vários tratamentos são usados para retardar os danos por corrosão em objetos metálicos expostos ao clima, água salgada, ácidos ou outros ambientes hostis. Uma vez que existem muitas formas de corrosão, existem muitas maneiras de parar ou mitigar a corrosão. Em todos os casos, depende do material a ser protegido e também do ambiente em que o material é utilizado. Os metais podem ser protegidos da corrosão usando um metal em um ambiente ao qual ele é imune, fazendo uma barreira física entre o metal e seu ambiente,
- Seleção de Materiais. Talvez a maneira mais comum e fácil de prevenir a corrosão seja através da seleção criteriosa de materiais, uma vez que o ambiente de corrosão tenha sido caracterizado. Alguns metais ferrosos e muitos não ferrosos e ligas são amplamente utilizados em ambientes corrosivos. Em todos os casos, depende fortemente de determinado ambiente e outras condições. Aqui, o custo pode ser um fator significativo. Nem sempre é economicamente viável empregar o material que oferece a melhor resistência à corrosão.
- Tratamento Superficial Anticorrosivo. Um revestimento fornece proteção formando uma barreira física entre o substrato metálico e um ambiente corrosivo aquoso. Os revestimentos protegem as estruturas metálicas da corrosão por efeitos de inibição e barreira. O efeito de barreira depende da adesão à subcamada, mas também das propriedades não condutoras do revestimento. A penetração de água ou íons é uma das principais causas de perda da barreira, o que pode levar à delaminação do revestimento e corrosão sob o filme. Revestimento, pintura e aplicação de esmalte são os tratamentos anticorrosivos mais comuns.
- Anodização. A anodização é um processo de passivação eletrolítica usado para aumentar a espessura da camada de óxido natural na superfície das peças metálicas. Um número limitado de metais, como aços inoxidáveis, pode atingir a passividade. O processo é chamado de anodização porque a peça a ser tratada forma o eletrodo anódico de uma célula eletrolítica. As ligas de alumínio são geralmente anodizadas para aumentar a resistência à corrosão e permitir o tingimento (coloração).
- Proteção catódica. A protecção catódica é uma forma muito eficaz de protecção contra a corrosão baseada na utilização de um material mais anódico do que o metal a proteger. O metal protegido é conectado eletricamente a outro metal que é mais reativo no ambiente específico. O metal menos resistente à corrosão torna-se ânodo e o metal com maior resistência à corrosão torna-se cátodo. A corrosão da resistência menos corrosiva geralmente é aumentada e o ataque em material mais resistente é diminuído. Existe uma diferença no potencial elétrico entre os diferentes metais e serve como força motriz para o fluxo de corrente elétrica através do corrosivo ou eletrólito. Os sistemas de proteção catódica são mais comumente usados para proteger estruturas metálicas enterradas ou submersas da corrosão, como tubulações e tanques de aço. magnésio, zinco, e ligas de alumínio são ânodos de sacrifício comuns. Ânodos de magnésio são mais comumente usados para aplicações de solo enterrado. O zinco é mais frequentemente usado para aplicações marinhas de água doce e salgada. As ligas de alumínio são mais frequentemente usadas para estruturas offshore.
- Inibidores de Corrosão. Se o ambiente for controlado (especialmente em sistemas de recirculação), frequentemente podem ser adicionados inibidores de corrosão. Esses produtos químicos formam um revestimento eletricamente isolante ou quimicamente impermeável em superfícies metálicas expostas, para suprimir reações eletroquímicas. Os inibidores de corrosão são produtos químicos que, quando adicionados ao meio ambiente em concentrações relativamente baixas, reduzem a taxa de um processo corrosivo. Qual substância que age como inibidor depende tanto do ambiente corrosivo quanto da liga. Os inibidores são normalmente usados em sistemas fechados, como radiadores de automóveis e caldeiras de vapor. Um exemplo desse princípio é o uso de anticongelante em carros. A eficácia de um inibidor depende de vários mecanismos diferentes. Alguns reagem com as espécies quimicamente ativas na solução, enquanto outros reagem com a superfície corrosiva e interferem na reação corrosiva ou formam uma fina camada protetora. Por exemplo, o oxigênio é geralmente removido por inibidores redutores, como aminas e hidrazinas. Neste exemplo, a hidrazina converte oxigênio, um agente corrosivo comum, em água, que geralmente é benigna. Muitos inibidores também são tóxicos e, portanto, não são adequados para uso em todas as aplicações. Outra limitação dos inibidores é que eles geralmente perdem a eficácia quando a temperatura e a concentração do ambiente aumentam. um agente corrosivo comum, à água, que geralmente é benigna. Muitos inibidores também são tóxicos e, portanto, não são adequados para uso em todas as aplicações. Outra limitação dos inibidores é que eles geralmente perdem a eficácia quando a temperatura e a concentração do ambiente aumentam. um agente corrosivo comum, à água, que geralmente é benigna. Muitos inibidores também são tóxicos e, portanto, não são adequados para uso em todas as aplicações. Outra limitação dos inibidores é que eles geralmente perdem a eficácia quando a temperatura e a concentração do ambiente aumentam.
Ligas resistentes à corrosão
As ligas resistentes à corrosão, como o próprio nome indica, são ligas com maior resistência à corrosão. Alguns metais ferrosos e muitos não ferrosos e ligas são amplamente utilizados em ambientes corrosivos. Em todos os casos, depende fortemente de determinado ambiente e outras condições. Ligas resistentes à corrosão são usadas para tubulações de água e muitas aplicações químicas e industriais. No caso de ligas ferrosas, estamos falando de aços inoxidáveis e, até certo ponto, de ferros fundidos. Mas algumas ligas não ferrosas resistentes à corrosão exibem notável resistência à corrosão e, portanto, podem ser usadas para muitos propósitos especiais. Existem duas razões principais pelas quais os materiais não ferrosos são preferidos aos aços e aços inoxidáveis para muitas dessas aplicações. Por exemplo, muitos dos os metais não ferrosos e as ligas possuem uma resistência muito maior à corrosão do que os aços-liga disponíveis e os tipos de aço inoxidável. Em segundo lugar, uma alta relação resistência/peso ou alta condutividade térmica e elétrica pode fornecer uma vantagem distinta sobre uma liga ferrosa.
CRUDs em Usinas Elétricas
Na engenharia nuclear, “ CRUD ” é um termo técnico para corrosão e produtos de desgaste (partículas de ferrugem, etc.) no refrigerante que se tornam radioativos quando expostos à radiação. O termo é na verdade um acrônimo para Chalk River Unidentified Deposits, originalmente encontrado no revestimento, ou revestimento externo, de varetas de combustível no reator canadense para o qual foi nomeado. CRUD pode ser definido como produtos de corrosão circulantes depositados ou suspensos, principalmente óxidos metálicos, formados pela reação da água com materiais de tubulação. De acordo com o ICRP, o CRUD formado nas usinas é a principal fonte de exposição do operador à radiação.
Além desses aspectos radiológicos, os CRUDs podem ter uma série de efeitos adversos na planta e seus componentes. Estes podem incluir o seguinte:
- Incrustação mecânica do equipamento.
- Aumento na queda de pressão através do núcleo
A usina deve ser projetada para minimizar a corrosão e a deposição. Esse projeto inclui a remoção eficiente de produtos de corrosão, o sistema de purificação, o projeto e a organização de equipamentos para minimizar a deposição de petróleo bruto e a seleção da química do refrigerante para reduzir a corrosão.
Ciência de materiais:
- Departamento de Energia dos EUA, Ciência de Materiais. DOE Fundamentals Handbook, Volume 1 e 2. Janeiro de 1993.
- Departamento de Energia dos EUA, Ciência de Materiais. DOE Fundamentals Handbook, Volume 2 e 2. Janeiro de 1993.
- William D. Callister, David G. Rethwisch. Ciência e Engenharia de Materiais: Uma Introdução 9ª Edição, Wiley; 9 edição (4 de dezembro de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por que as coisas quebram: entendendo o mundo pela maneira como ele se desfaz. Harmonia. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introdução à Termodinâmica dos Materiais (4ª ed.). Editora Taylor e Francis. ISBN 978-1-56032-992-3.
- González-Viñas, W. & Mancini, HL (2004). Uma Introdução à Ciência dos Materiais. Princeton University Press. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiais: engenharia, ciência, processamento e design (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introdução à Engenharia Nuclear, 3ª ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
Esperamos que este artigo, Corrosão, o ajude. Se sim, dê um like na barra lateral. O objetivo principal deste site é ajudar o público a aprender algumas informações interessantes e importantes sobre materiais e suas propriedades.