En los sólidos se encuentran tres tipos diferentes de enlaces primarios o químicos:
Enlaces intramoleculares
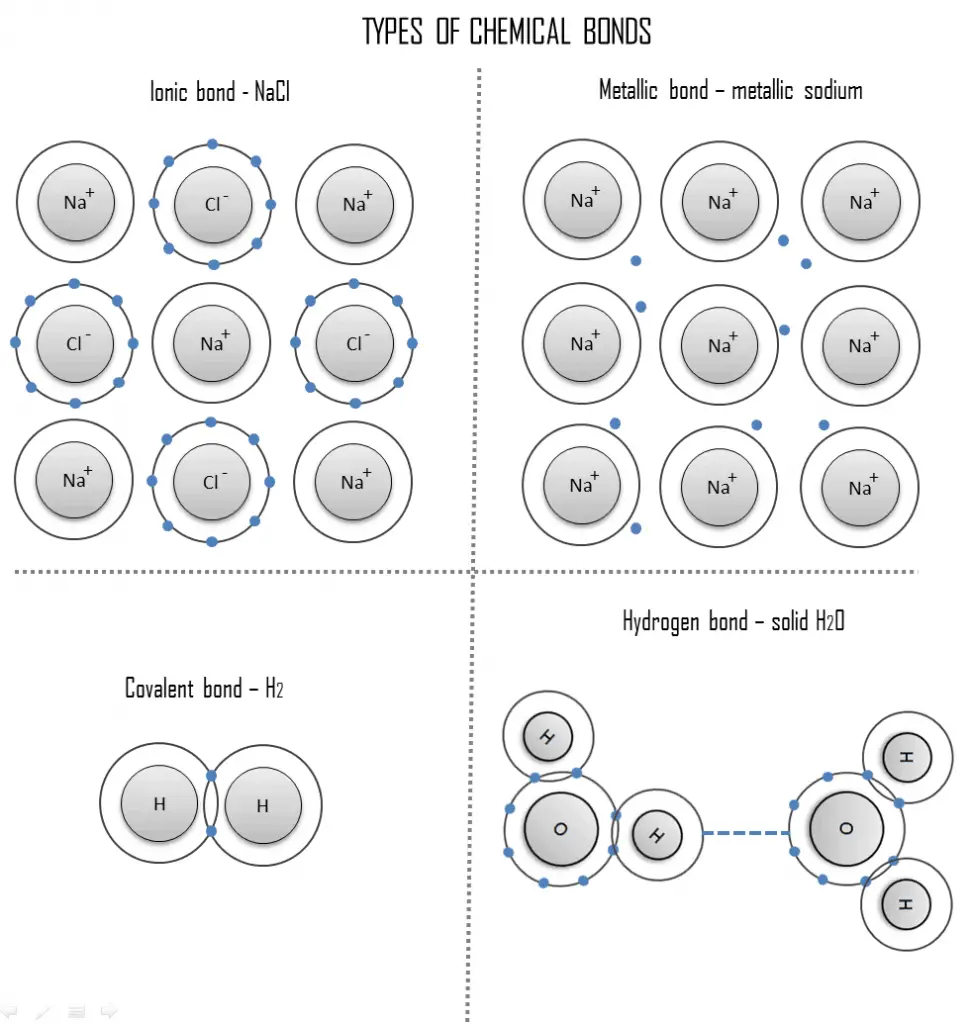
- Enlace iónico . Un enlace iónico es un enlace químico, en el que uno o más electrones se transfieren por completo de un átomo de un elemento al átomo del otro, y los elementos se mantienen unidos por la fuerza de atracción debida a la polaridad opuesta de la carga. Este tipo de enlace químico es típico entre elementos con una gran diferencia de electronegatividad.
- Enlace covalente . Un enlace covalente es un enlace químico formado por electrones compartidos. Los electrones de valencia se comparten cuando un átomo necesita electrones para completar su capa exterior y puede compartir esos electrones con su vecino. Los electrones son entonces parte de ambos átomos y ambas capas se llenan.
- Enlace metálico . Un enlace metálico es un enlace químico, en el que los átomos no comparten ni intercambian electrones para unirse. En cambio, muchos electrones (aproximadamente uno por cada átomo) son más o menos libres para moverse por el metal, de modo que cada electrón puede interactuar con muchos de los átomos fijos.
Enlaces intermoleculares
- Enlace molecular. Cuando los electrones de los átomos neutros pasan más tiempo en una región de su órbita, existirá una carga débil temporal. La molécula atraerá débilmente a otras moléculas. Esto a veces se denomina enlaces de van der Waals o moleculares.
- Enlace de hidrógeno . Un enlace de hidrógeno puede ser intermolecular (que ocurre entre moléculas separadas) o intramolecular (que ocurre entre partes de la misma molécula). El enlace de hidrógeno es una fuerza de atracción principalmente electrostática entre un átomo de hidrógeno (H) que está unido covalentemente a un átomo o grupo más electronegativo.
La fuerza de los enlaces químicos varía considerablemente; existen " enlaces primarios " o " enlaces fuertes " como los enlaces iónicos, covalentes y metálicos, y " enlaces débiles " o " enlaces secundarios " como las interacciones dipolo-dipolo, la fuerza de dispersión de London y el enlace de hidrógeno. En este capítulo, nos ocuparemos principalmente de los sólidos porque los sólidos son lo más importante en las aplicaciones de ingeniería de los materiales. Los líquidos y gases se mencionarán únicamente con fines comparativos. Las moléculas de los sólidos están unidas estrechamente. Cuando las atracciones son más débiles, la sustancia puede estar en forma líquida y fluir libremente. Los gases no exhiben virtualmente fuerzas de atracción entre átomos o moléculas,
El tipo de unión no solo determina qué tan bien se mantiene unido un material, sino que también determina qué propiedades microscópicas posee el material. Propiedades como la capacidad de conducir calor o corriente eléctrica están determinadas por la libertad de movimiento de los electrones. Esto depende del tipo de unión presente. El conocimiento de la estructura microscópica de un material nos permite predecir cómo se comportará ese material en determinadas condiciones.
[/ lgc_column]
Ciencia de los materiales:
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
[/ su_spoiler] [/ su_accordion]
[/ lgc_column]Véase más arriba:
Enlace químico [/ su_button] [/ lgc_column]
Esperamos que este artículo, Tipos de enlaces químicos , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.