À propos d’Actinium
L’actinium est un métal radioactif mou, blanc argenté. L’actinium a donné le nom à la série des actinides, un groupe de 15 éléments similaires entre l’actinium et le lawrencium dans le tableau périodique.
Affinité électronique – Actinium
L’affinité électronique de l’ actinium est de – kJ/mol.
En chimie et en physique atomique, l’ affinité électronique d’un atome ou d’une molécule est définie comme:
la variation d’énergie (en kJ/mole) d’un atome ou d’une molécule neutre (en phase gazeuse) lorsqu’un électron est ajouté à l’atome pour former un ion négatif.
X + e – → X – + énergie Affinité = – ∆H
En d’autres termes, il peut être exprimé comme la probabilité qu’a l’atome neutre de gagner un électron. Notez que les énergies d’ionisation mesurent la tendance d’un atome neutre à résister à la perte d’électrons. Les affinités électroniques sont plus difficiles à mesurer que les énergies d’ionisation.
Electronégativité de l’Actinium
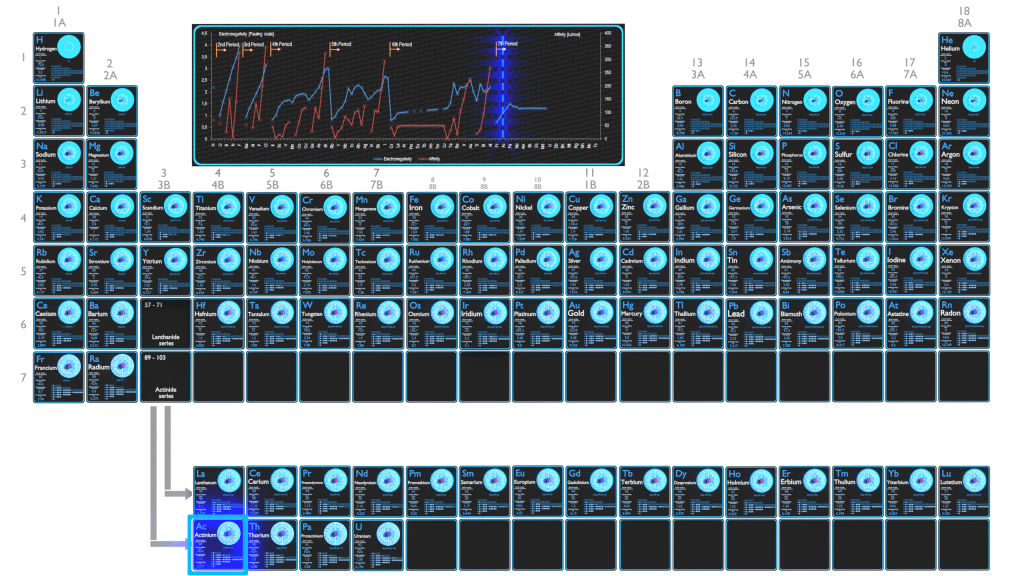
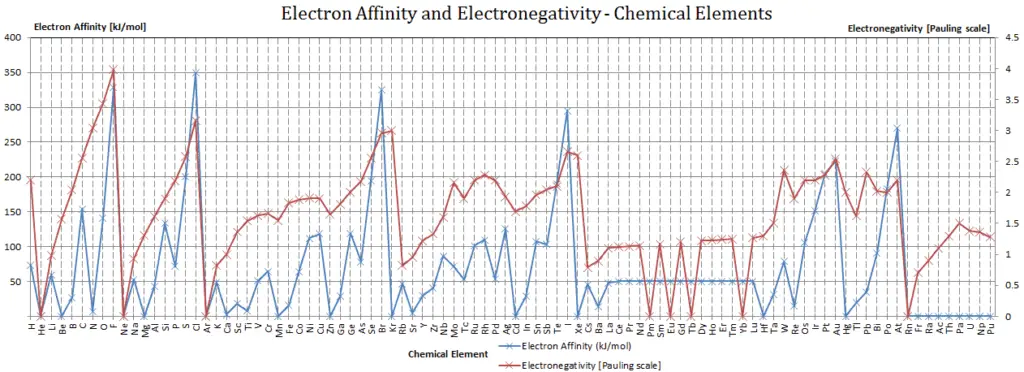
L’ électronégativité de l’ actinium est de 1,1.
L’électronégativité, symbole χ, est une propriété chimique qui décrit la tendance d’un atome à attirer des électrons vers cet atome. A cet effet, une quantité sans dimension l’ échelle de Pauling, symbole χ, est la plus couramment utilisée.
L’électronégativité de l’actinium est: χ = 1,1
Première énergie d’ionisation de l’Actinium
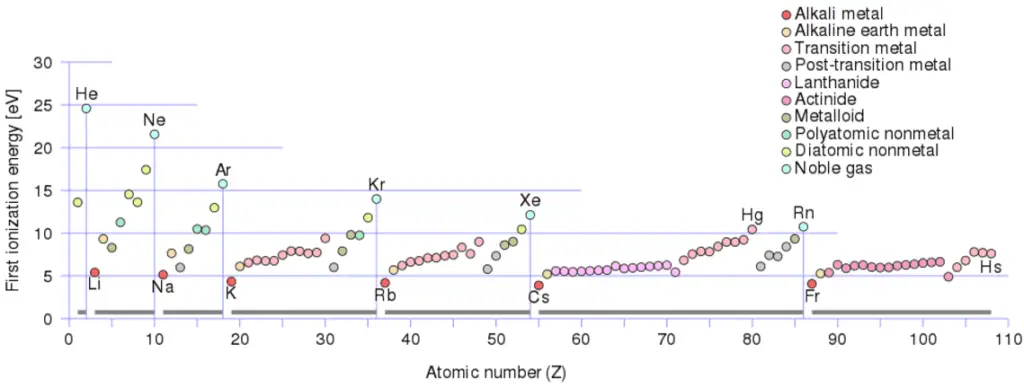
La première énergie d’ionisation de l’actinium est de 5,17 eV .
L’énergie d’ionisation, également appelée potentiel d’ionisation, est l’énergie nécessaire pour retirer un électron de l’atome neutre.
X + énergie → X + + e −
où X est n’importe quel atome ou molécule capable d’être ionisé, X+ est cet atome ou molécule avec un électron retiré (ion positif), et e– est l’électron retiré.
Un atome d’actinium, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus externe.
Ac + IE → Ac + + e – IE = 5,17 eV
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre d’ actinium est de 89. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique d’ actinium est [Rn] 6d1 7s2.
Les états d’oxydation possibles sont +3.
À propos de l'affinité électronique
En chimie et en physique atomique, l’ affinité électronique d’un atome ou d’une molécule est définie comme:
la variation d’énergie (en kJ/mole) d’un atome ou d’une molécule neutre (en phase gazeuse) lorsqu’un électron est ajouté à l’atome pour former un ion négatif.
X + e – → X – + énergie Affinité = – ∆H
En d’autres termes, il peut être exprimé comme la probabilité qu’a l’atome neutre de gagner un électron. Notez que les énergies d’ionisation mesurent la tendance d’un atome neutre à résister à la perte d’électrons. Les affinités électroniques sont plus difficiles à mesurer que les énergies d’ionisation.
Un atome d’actinium en phase gazeuse, par exemple, dégage de l’énergie lorsqu’il gagne un électron pour former un ion d’actinium.
Ac + e – → Ac – – ∆H = Affinité = – kJ / mol
Pour utiliser correctement les affinités électroniques, il est essentiel de garder une trace du signe. Lorsqu’un électron est ajouté à un atome neutre, de l’énergie est libérée. Cette affinité est connue sous le nom de première affinité électronique et ces énergies sont négatives. Par convention, le signe négatif indique un dégagement d’énergie. Cependant, plus d’énergie est nécessaire pour ajouter un électron à un ion négatif qui submerge toute la libération d’énergie du processus de fixation des électrons. Cette affinité est connue sous le nom de deuxième affinité électronique et ces énergies sont positives.
 L’affinité électronique peut être une valeur positive ou négative. Plus la valeur négative est grande, plus l’anion est stable. Bien que l’affinité varie considérablement à travers le tableau périodique, certains modèles émergent. Généralement, les éléments du côté droit du tableau périodique auront une grande affinité électronique négative. Les affinités électroniques deviendront moins négatives au fur et à mesure que vous passerez du haut vers le bas du tableau périodique. Cependant, l’azote, l’oxygène et le fluor ne suivent pas cette tendance. De plus, les non-métaux ont une affinité plus positive que les métaux. Les atomes dont les anions sont plus stables que les atomes neutres ont une plus grande affinité. Le chlore attire le plus fortement les électrons supplémentaires, tandis que le néon attire le plus faiblement un électron supplémentaire.
L’affinité électronique peut être une valeur positive ou négative. Plus la valeur négative est grande, plus l’anion est stable. Bien que l’affinité varie considérablement à travers le tableau périodique, certains modèles émergent. Généralement, les éléments du côté droit du tableau périodique auront une grande affinité électronique négative. Les affinités électroniques deviendront moins négatives au fur et à mesure que vous passerez du haut vers le bas du tableau périodique. Cependant, l’azote, l’oxygène et le fluor ne suivent pas cette tendance. De plus, les non-métaux ont une affinité plus positive que les métaux. Les atomes dont les anions sont plus stables que les atomes neutres ont une plus grande affinité. Le chlore attire le plus fortement les électrons supplémentaires, tandis que le néon attire le plus faiblement un électron supplémentaire.
Affinités des non-métaux vs. Affinités des métaux
- Métaux: les métaux aiment perdre des électrons de valence pour former des cations afin d’avoir une coque totalement stable. L’affinité électronique des métaux est inférieure à celle des non-métaux. Mercure attire le plus faiblement un électron supplémentaire.
- Non-métaux: généralement, les non-métaux ont une affinité électronique plus positive que les métaux. Les non-métaux aiment gagner des électrons pour former des anions afin d’avoir une couche d’électrons entièrement stable. Le chlore attire le plus fortement les électrons supplémentaires. Les affinités électroniques des gaz nobles n’ont pas été mesurées de manière concluante, elles peuvent donc ou non avoir des valeurs légèrement négatives.
Affinité des éléments
Électronégativité des éléments

Énergie d’ionisation des éléments
À propos de l'électronégativité
L’électronégativité , symbole χ, est une propriété chimique qui décrit la tendance d’un atome à attirer des électrons vers cet atome. A cet effet, une quantité sans dimension l’ échelle de Pauling , symbole χ, est la plus couramment utilisée.
L’électronégativité de l’actinium est : χ = 1,1
 En général, l’ électronégativité d’un atome est affectée à la fois par son numéro atomique et la distance à laquelle ses électrons de valence résident du noyau chargé. Plus le nombre d’électronégativité associé est élevé, plus un élément ou un composé attire les électrons vers lui. L’atome le plus électronégatif, le fluor, se voit attribuer une valeur de 4,0, et les valeurs vont jusqu’au césium et au francium qui sont les moins électronégatifs à 0,7. L’électronégativité est liée à l’énergie d’ionisation et à l’affinité électronique. Les électrons à faible énergie d’ionisation ont de faibles électronégativités car leurs noyaux n’exercent pas une forte force d’attraction sur les électrons. Les éléments à hautes énergies d’ionisation ont des électronégativités élevées en raison de la forte attraction exercée par le noyau positif sur les électrons négatifs. Par conséquent, l’électronégativité est la plus grande en haut à droite du tableau périodique et diminue vers le bas à gauche.
En général, l’ électronégativité d’un atome est affectée à la fois par son numéro atomique et la distance à laquelle ses électrons de valence résident du noyau chargé. Plus le nombre d’électronégativité associé est élevé, plus un élément ou un composé attire les électrons vers lui. L’atome le plus électronégatif, le fluor, se voit attribuer une valeur de 4,0, et les valeurs vont jusqu’au césium et au francium qui sont les moins électronégatifs à 0,7. L’électronégativité est liée à l’énergie d’ionisation et à l’affinité électronique. Les électrons à faible énergie d’ionisation ont de faibles électronégativités car leurs noyaux n’exercent pas une forte force d’attraction sur les électrons. Les éléments à hautes énergies d’ionisation ont des électronégativités élevées en raison de la forte attraction exercée par le noyau positif sur les électrons négatifs. Par conséquent, l’électronégativité est la plus grande en haut à droite du tableau périodique et diminue vers le bas à gauche.
À propos de l'énergie d'ionisation
La première énergie d’ionisation de l’actinium est de 5,17 eV .
L’énergie d’ionisation, également appelée potentiel d’ionisation, est l’énergie nécessaire pour retirer un électron de l’atome neutre.
X + énergie → X + + e −
où X est n’importe quel atome ou molécule capable d’être ionisé, X + est cet atome ou molécule avec un électron retiré (ion positif), et e – est l’électron retiré.
Un atome d’actinium, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus externe.
Ac + IE → Ac + + e – IE = 5,17 eV
L’énergie d’ionisation associée à l’élimination du premier électron est la plus couramment utilisée. La n ième énergie d’ionisation fait référence à la quantité d’énergie nécessaire pour éliminer un électron de l’espèce avec une charge de ( n -1).
1ère énergie d’ionisation
X → X + + e −
2ème énergie d’ionisation
X + → X 2+ + e −
3ème énergie d’ionisation
X 2+ → X 3+ + e −
Énergie d’ionisation pour différents éléments
Il existe une énergie d’ionisation pour chaque électron successif éliminé. Les électrons qui entourent le noyau se déplacent sur des orbites assez bien définies. Certains de ces électrons sont plus étroitement liés dans l’atome que d’autres. Par exemple, seulement 7,38 eV sont nécessaires pour éliminer l’électron le plus externe d’un atome de plomb, tandis que 88 000 eV sont nécessaires pour éliminer l’électron le plus interne. Aide à comprendre la réactivité des éléments (en particulier les métaux, qui perdent des électrons).
 En général, l’ énergie d’ionisation augmente en remontant d’un groupe et en se déplaçant de gauche à droite sur une période. L’énergie d’ionisation est liée à l’électronégativité et à l’affinité électronique. Les électrons à faible énergie d’ionisation ont de faibles électronégativités car leurs noyaux n’exercent pas une forte force d’attraction sur les électrons. Les éléments à hautes énergies d’ionisation ont des électronégativités élevées en raison de la forte attraction exercée par le noyau positif sur les électrons négatifs. Par conséquent, l’électronégativité est la plus grande en haut à droite du tableau périodique et diminue vers le bas à gauche. En outre:
En général, l’ énergie d’ionisation augmente en remontant d’un groupe et en se déplaçant de gauche à droite sur une période. L’énergie d’ionisation est liée à l’électronégativité et à l’affinité électronique. Les électrons à faible énergie d’ionisation ont de faibles électronégativités car leurs noyaux n’exercent pas une forte force d’attraction sur les électrons. Les éléments à hautes énergies d’ionisation ont des électronégativités élevées en raison de la forte attraction exercée par le noyau positif sur les électrons négatifs. Par conséquent, l’électronégativité est la plus grande en haut à droite du tableau périodique et diminue vers le bas à gauche. En outre:
- L’énergie d’ionisation est la plus faible pour les métaux alcalins qui ont un seul électron à l’extérieur d’une coquille fermée.
- L’énergie d’ionisation augmente sur une ligne sur le maximum périodique pour les gaz nobles qui ont des enveloppes fermées.
Par exemple, le sodium ne nécessite que 496 kJ/mol ou 5,14 eV/atome pour l’ioniser. Par contre le néon, le gaz rare qui le précède immédiatement dans le tableau périodique, nécessite 2081 kJ/mol ou 21,56 eV/atome.
À propos des électrons et de la configuration des électrons
Le tableau périodique est un affichage tabulaire des éléments chimiques organisés en fonction de leurs numéros atomiques, de leurs configurations électroniques et de leurs propriétés chimiques. La configuration électronique est la distribution des électrons d’un atome ou d’une molécule (ou d’une autre structure physique) dans des orbitales atomiques ou moléculaires. La connaissance de la configuration électronique des différents atomes est utile pour comprendre la structure du tableau périodique des éléments.
Chaque solide, liquide, gaz et plasma est composé d’atomes neutres ou ionisés. Les propriétés chimiques de l’atome sont déterminées par le nombre de protons, en fait, par le nombre et la disposition des électrons. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
It is the Pauli exclusion principle that requires the electrons in an atom to occupy different energy levels instead of them all condensing in the ground state. The ordering of the electrons in the ground state of multielectron atoms, starts with the lowest energy state (ground state) and moves progressively from there up the energy scale until each of the atom’s electrons has been assigned a unique set of quantum numbers. This fact has key implications for the building up of the periodic table of elements.
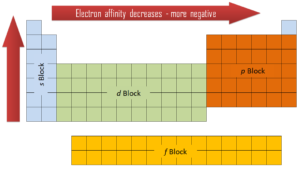
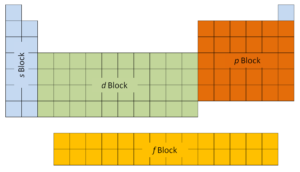 Les deux premières colonnes sur le côté gauche du tableau périodique sont celles où les sous-couches s sont occupées. Pour cette raison, les deux premières lignes du tableau périodique sont étiquetées le bloc s. De même, le bloc p sont les six colonnes les plus à droite du tableau périodique, le bloc d est les 10 colonnes du milieu du tableau périodique, tandis que le bloc f est la section de 14 colonnes qui est normalement représentée comme détachée du corps principal. du tableau périodique. Il pourrait faire partie du corps principal, mais alors le tableau périodique serait plutôt long et encombrant.
Les deux premières colonnes sur le côté gauche du tableau périodique sont celles où les sous-couches s sont occupées. Pour cette raison, les deux premières lignes du tableau périodique sont étiquetées le bloc s. De même, le bloc p sont les six colonnes les plus à droite du tableau périodique, le bloc d est les 10 colonnes du milieu du tableau périodique, tandis que le bloc f est la section de 14 colonnes qui est normalement représentée comme détachée du corps principal. du tableau périodique. Il pourrait faire partie du corps principal, mais alors le tableau périodique serait plutôt long et encombrant.
Pour les atomes avec de nombreux électrons, cette notation peut devenir longue et donc une notation abrégée est utilisée. La configuration électronique peut être visualisée comme les électrons de cœur, équivalents au gaz rare de la période précédente, et les électrons de valence (par exemple [Xe] 6s2 pour le baryum).
États d’oxydation
Les états d’oxydation sont généralement représentés par des nombres entiers qui peuvent être positifs, nuls ou négatifs. La plupart des éléments ont plus d’un état d’oxydation possible. Par exemple, le carbone a neuf états d’oxydation entiers possibles de -4 à +4.
La définition actuelle de l’état d’oxydation du livre d’or IUPAC est:
« L’état d’oxydation d’un atome est la charge de cet atome après approximation ionique de ses liaisons hétéronucléaires… »
et le terme nombre d’oxydation est presque synonyme. Un élément qui n’est combiné à aucun autre élément différent a un état d’oxydation de 0. L’état d’oxydation 0 se produit pour tous les éléments – c’est simplement l’élément sous sa forme élémentaire. Un atome d’un élément dans un composé aura un état d’oxydation positif s’il a eu des électrons retirés. De même, l’ajout d’électrons entraîne un état d’oxydation négatif. Nous avons également distingué les états d’oxydation possibles et communs de chaque élément. Par exemple, le silicium a neuf états d’oxydation entiers possibles de -4 à +4, mais seuls -4, 0 et +4 sont des états d’oxydation communs.
Résumé
| Élément |
Actinium |
| Nombre d’électrons |
89 |
| Configuration électronique |
[Rn] 6d1 7s2 |
| États d’oxydation |
+3 |
| Affinité électronique [kJ/mol] |
– |
| Electronégativité [échelle de Pauling] |
1,1 |
| Première énergie d’ionisation [eV] |
5,17 |

Source : www.luciteria.com
Propriétés des autres éléments
Autres propriétés de l’Actinium