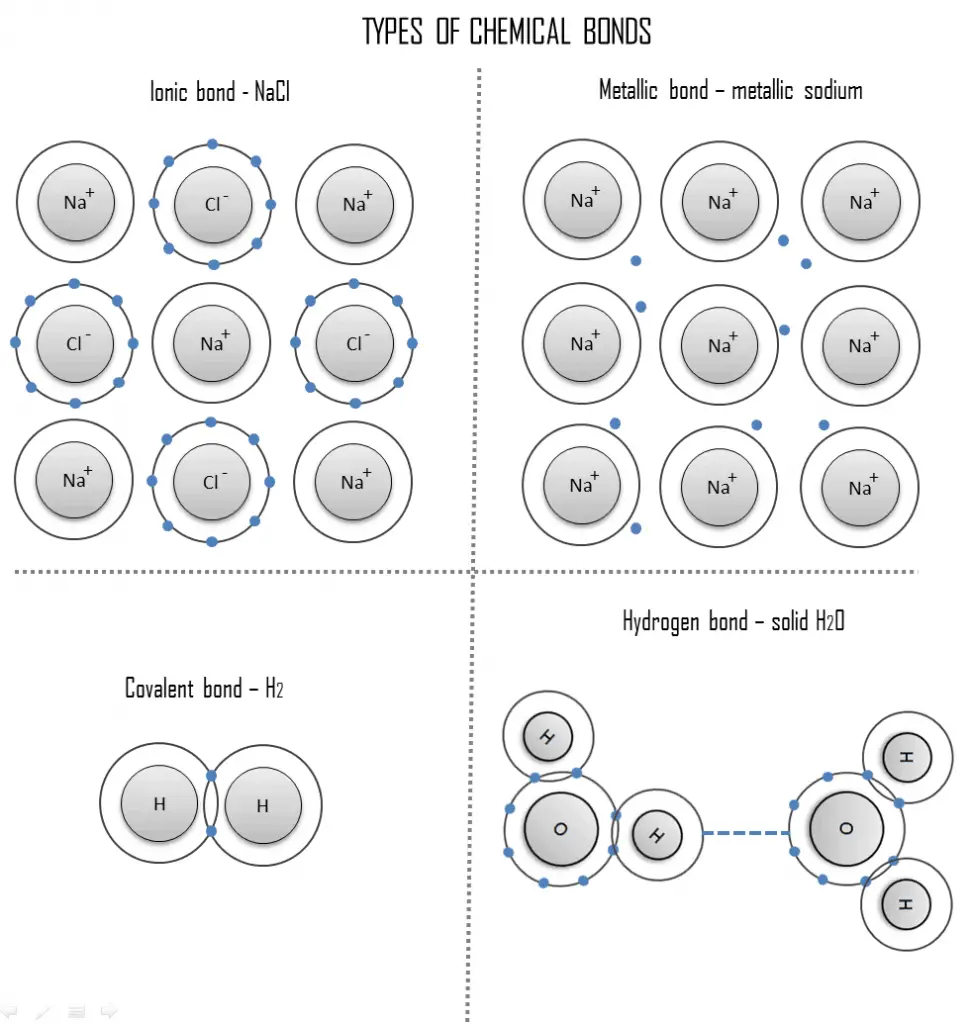
Une liaison chimique est une attraction durable entre ces atomes, ions ou molécules qui permet la formation de composés chimiques. La liaison peut résulter de la force électrostatique d’attraction entre des ions chargés de manière opposée comme dans les liaisons ioniques ou par le partage d’électrons comme dans les liaisons covalentes. Par conséquent, la force électromagnétique joue un rôle majeur dans la détermination des propriétés internes de la plupart des objets rencontrés dans la vie quotidienne.
Liaisons intramoléculaires
- Liaison ionique. Une liaison ionique est une liaison chimique, dans laquelle un ou plusieurs électrons sont entièrement transférés d’un atome d’un élément à l’atome de l’autre, et les éléments sont maintenus ensemble par la force d’attraction due à la polarité opposée de la charge. Ce type de liaison chimique est typique entre les éléments avec une grande différence d’électronégativité.
- Liaison covalente. Une liaison covalente est une liaison chimique formée par des électrons partagés. Les électrons de Valence sont partagés lorsqu’un atome a besoin d’électrons pour compléter sa coque externe et peut partager ces électrons avec son voisin. Les électrons font alors partie des deux atomes et les deux coquilles sont remplies.
- Liaison métallique. Une liaison métallique est une liaison chimique, dans laquelle les atomes ne partagent pas ou n’échangent pas d’électrons pour se lier. Au lieu de cela, de nombreux électrons (environ un pour chaque atome) sont plus ou moins libres de se déplacer dans le métal, de sorte que chaque électron peut interagir avec de nombreux atomes fixes.
Une liaison covalente
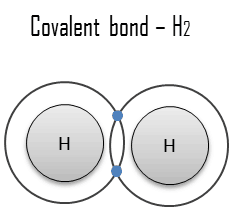 Une liaison covalente est une liaison chimique formée par des électrons partagés. Les électrons de Valence sont partagés lorsqu’un atome a besoin d’électrons pour compléter sa coque externe et peut partager ces électrons avec son voisin. Les électrons font alors partie des deux atomes et les deux coquilles sont remplies. Ces paires d’électrons sont appelées paires partagées ou paires de liaison, et l’équilibre stable des forces attractives et répulsives entre les atomes, lorsqu’ils partagent des électrons, est appelé liaison covalente.
Une liaison covalente est une liaison chimique formée par des électrons partagés. Les électrons de Valence sont partagés lorsqu’un atome a besoin d’électrons pour compléter sa coque externe et peut partager ces électrons avec son voisin. Les électrons font alors partie des deux atomes et les deux coquilles sont remplies. Ces paires d’électrons sont appelées paires partagées ou paires de liaison, et l’équilibre stable des forces attractives et répulsives entre les atomes, lorsqu’ils partagent des électrons, est appelé liaison covalente.
Le type le plus simple et le plus courant est une liaison simple dans laquelle deux atomes partagent deux électrons. D’autres types comprennent la double liaison (par exemple H2C = CH2), la triple liaison, les liaisons à un et trois électrons, la liaison à deux électrons à trois centres et la liaison à quatre électrons à trois centres.
La covalence est la plus grande entre des atomes d’ électronégativités similaires . Ainsi, la liaison covalente n’exige pas nécessairement que les deux atomes soient des mêmes éléments, seulement qu’ils soient d’ électronégativité comparable (c’est-à-dire des éléments proches les uns des autres dans le tableau périodique). Il n’y a pas de valeur précise qui distingue la liaison ionique de la liaison covalente, mais une différence d’électronégativité supérieure à 1,7 est susceptible d’être ionique tandis qu’une différence inférieure à 1,7 est susceptible d’être covalente.
Lien métallique
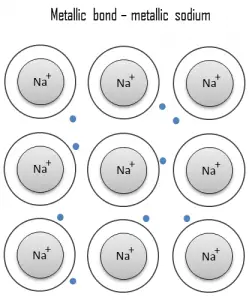 Une liaison métallique est une liaison chimique, dans laquelle les atomes ne partagent pas ou n’échangent pas d’électrons pour se lier. Au lieu de cela, de nombreux électrons (environ un pour chaque atome) sont plus ou moins libres de se déplacer dans le métal, de sorte que chaque électron peut interagir avec de nombreux atomes fixes. Les électrons libres protègent les noyaux ioniques chargés positivement des forces électrostatiques mutuellement répulsives qu’ils exerceraient autrement les uns sur les autres; par conséquent, la liaison métallique est de caractère non directionnel. La liaison métallique se trouve dans les métaux et leurs alliages. Le libre mouvement ou la délocalisation des électrons de liaison conduit à des propriétés métalliques classiques telles que le lustre (réflectivité de la lumière de surface), la conductivité électrique et thermique, la ductilité et la résistance à la traction élevée.
Une liaison métallique est une liaison chimique, dans laquelle les atomes ne partagent pas ou n’échangent pas d’électrons pour se lier. Au lieu de cela, de nombreux électrons (environ un pour chaque atome) sont plus ou moins libres de se déplacer dans le métal, de sorte que chaque électron peut interagir avec de nombreux atomes fixes. Les électrons libres protègent les noyaux ioniques chargés positivement des forces électrostatiques mutuellement répulsives qu’ils exerceraient autrement les uns sur les autres; par conséquent, la liaison métallique est de caractère non directionnel. La liaison métallique se trouve dans les métaux et leurs alliages. Le libre mouvement ou la délocalisation des électrons de liaison conduit à des propriétés métalliques classiques telles que le lustre (réflectivité de la lumière de surface), la conductivité électrique et thermique, la ductilité et la résistance à la traction élevée.
Le métal est un matériau (généralement solide) comprenant un ou plusieurs éléments métalliques (par exemple, le fer, l’aluminium, le cuivre, le chrome, le titane, l’or, le nickel), et souvent aussi des éléments non métalliques (par exemple, le carbone, l’azote, l’oxygène) en quantités relativement faibles . La particularité des métaux en ce qui concerne leur structure est la présence de porteurs de charge, en particulier d’ électrons. Cette caractéristique est donnée par la nature de la liaison métallique. Les conductivités électriques et thermiques des métaux proviennent du fait que leurs électrons externes sont délocalisés.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- González-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Covalent Bond vs Metallic Bond, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.