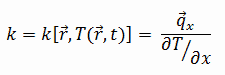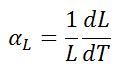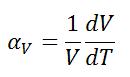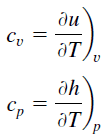Les propriétés thermiques des matériaux font référence à la réponse des matériaux aux changements de leur thermodynamics/thermodynamic-properties/what-is-temperature-physics/ »>température et à l’application de chaleur. Lorsqu’un solide absorbe de thermodynamics/what-is-energy-physics/ »>l’énergie sous forme de chaleur, sa température augmente et ses dimensions augmentent. Mais différents matériaux réagissent différemment à l’application de chaleur.
La capacité calorifique, la dilatation thermique et la conductivité thermique sont des propriétés qui sont souvent critiques dans l’utilisation pratique des solides.
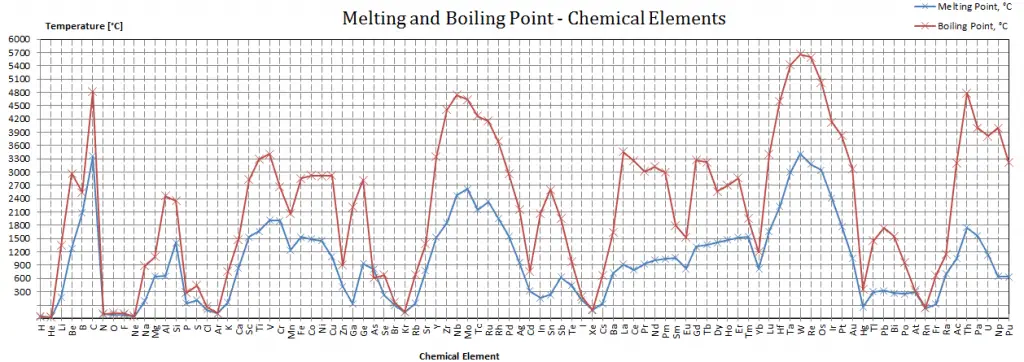
Point de fusion – Point d’ébullition des matériaux
Notez que ces points sont associés à la pression atmosphérique standard.
Point de fusion
Voir aussi: Points de fusion – Tableau périodique
En général, la fusion est un changement de phase d’une substance de la phase solide à la phase liquide. Le point de fusion d’une substance est la température à laquelle ce changement de phase se produit. Le point de fusion définit également une condition dans laquelle le solide et le liquide peuvent exister en équilibre. L’ajout d’une chaleur convertira le solide en liquide sans changement de température. Au point de fusion, les deux phases d’une substance, liquide et vapeur, ont des énergies libres identiques et sont donc également susceptibles d’exister. En dessous du point de fusion, le solide est l’état le plus stable des deux, alors qu’au-dessus, la forme liquide est préférée. Le point de fusion d’une substance dépend de la pression et est généralement spécifié à la pression standard. Considérée comme la température du passage inverse du liquide au solide, elle est appelée point de congélation ou point de cristallisation.
Voir aussi: Dépression du point de fusion
La première théorie expliquant le mécanisme de fusion dans la masse a été proposée par Lindemann, qui a utilisé la vibration des atomes dans le cristal pour expliquer la transition de fusion. Les solides sont similaires aux liquides en ce sens que les deux sont des états condensés, avec des particules beaucoup plus proches les unes des autres que celles d’un gaz. Les atomes d’un solide sont étroitement liés les uns aux autres, soit dans un réseau géométrique régulier (solides cristallins, qui comprennent les métaux et la glace ordinaire) ou irrégulièrement (un solide amorphe tel que le verre à vitre commun), et sont généralement de faible énergie. Le mouvement d’atomes, d’ions ou de molécules individuels dans un solide est limité au mouvement vibratoire autour d’un point fixe. Lorsqu’un solide est chauffé, ses particules vibrent plus rapidement car le solide absorbe l’énergie cinétique. À un moment donné, l’amplitude de vibration devient si grande que les atomes commencent à envahir l’espace de leurs plus proches voisins et à les déranger, et le processus de fusion s’enclenche. Le point de fusion est la température à laquelle les vibrations perturbatrices des particules du solide surmontent les forces d’attraction opérant à l’intérieur du solide.
Comme pour les points d’ébullition, le point de fusion d’un solide dépend de la force de ces forces attractives. Par exemple, le chlorure de sodium (NaCl) est un composé ionique constitué d’une multitude de liaisons ioniques fortes. Le chlorure de sodium fond à 801°C. D’autre part, la glace (solide H2O) est un composé moléculaire dont les molécules sont maintenues ensemble par des liaisons hydrogène, ce qui est effectivement un exemple fort d’une interaction entre deux dipôles permanents. Bien que les liaisons hydrogène soient les plus fortes des forces intermoléculaires, la force des liaisons hydrogène est bien inférieure à celle des liaisons ioniques. Le point de fusion de la glace est de 0 °C.
Les liaisons covalentes entraînent souvent la formation de petites collections d’atomes mieux connectés appelés molécules, qui, dans les solides et les liquides, sont liés à d’autres molécules par des forces souvent beaucoup plus faibles que les liaisons covalentes qui maintiennent les molécules ensemble en interne. Ces liaisons intermoléculaires faibles confèrent aux substances moléculaires organiques, telles que les cires et les huiles, leur caractère de masse molle et leurs points de fusion bas (dans les liquides, les molécules doivent cesser le contact le plus structuré ou orienté les unes avec les autres).
Point d’ébullition
Voir aussi: Points d’ébullition – Tableau périodique
En général, l’ébullition est un changement de phase d’une substance de la phase liquide à la phase gazeuse. Le point d’ébullition d’une substance est la température à laquelle se produit ce changement de phase (ébullition ou vaporisation). La température à laquelle la vaporisation (ébullition) commence à se produire pour une pression donnée est également connue sous le nom de température de saturation et dans ces conditions, un mélange de vapeur et de liquide peut exister ensemble. On peut dire que le liquide est saturé d’énergie thermique. Tout ajout d’énergie thermique entraîne une transition de phase. Au point d’ébullition les deux phases d’une substance, liquide et vapeur, ont des énergies libres identiques et sont donc également susceptibles d’exister. En dessous du point d’ébullition, le liquide est l’état le plus stable des deux, alors qu’au-dessus, la forme gazeuse est préférée. La pression à laquelle la vaporisation (ébullition) commence à se produire pour une température donnée est appelée la pression de saturation. Considérée comme la température du passage inverse de la vapeur au liquide, elle est appelée point de condensation.
Comme on peut le voir, le point d’ébullition d’un liquide varie en fonction de la pression environnementale environnante. Un liquide sous vide partiel a un point d’ébullition plus bas que lorsque ce liquide est à la pression atmosphérique. Un liquide à haute pression a un point d’ébullition plus élevé que lorsque ce liquide est à la pression atmosphérique. Par exemple, l’eau bout à 100 °C (212 °F) au niveau de la mer, mais à 93,4 °C (200,1 °F) à 1900 mètres (6 233 pieds) d’altitude. D’autre part, l’eau bout à 350 °C (662 °F) à 16,5 MPa (pression typique des REP).
Dans le tableau périodique des éléments, l’élément dont le point d’ébullition est le plus bas est l’hélium. Les points d’ébullition du rhénium et du tungstène dépassent 5000 K à la pression standard. Puisqu’il est difficile de mesurer précisément les températures extrêmes sans biais, les deux ont été cités dans la littérature comme ayant le point d’ébullition le plus élevé.
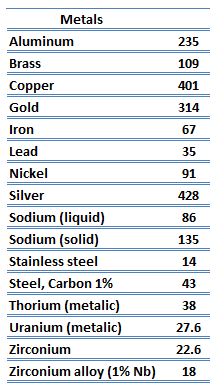
Conductivité thermique des matériaux
Les caractéristiques de transfert de chaleur d’un matériau solide sont mesurées par une propriété appelée la conductivité thermique, k (ou λ), mesurée en W/mK. C’est une mesure de la capacité d’une substance à transférer de la chaleur à travers un matériau par conduction. Notez que la loi de Fourier s’applique à toute matière, quel que soit son état (solide, liquide ou gaz), par conséquent, elle est également définie pour les liquides et les gaz.
La conductivité thermique de la plupart des liquides et des solides varie avec la température. Pour les vapeurs, cela dépend aussi de la pression. En général:
La plupart des matériaux sont presque homogènes, nous pouvons donc généralement écrire k = k (T). Des définitions similaires sont associées aux conductivités thermiques dans les directions y et z (ky, kz), mais pour un matériau isotrope, la conductivité thermique est indépendante de la direction de transfert, kx = ky = kz = k.
Conductivité thermique des métaux
- la migration des électrons libres
- ondes vibratoires du réseau (phonons)
Lorsque les électrons et les phonons transportent de l’énergie thermique conduisant à un transfert de chaleur par conduction dans un solide, la conductivité thermique peut être exprimée comme suit:
k = k e + k ph
 Les métaux sont des solides et en tant que tels, ils possèdent une structure cristalline où les ions (noyaux avec leurs enveloppes environnantes d’ électrons centraux ) occupent des positions équivalentes en translation dans le réseau cristallin. Les métaux en général ont une conductivité électrique élevée, une conductivité thermique élevée et une densité élevée. Ainsi, le transport d’énergie thermique peut être dû à deux effets:
Les métaux sont des solides et en tant que tels, ils possèdent une structure cristalline où les ions (noyaux avec leurs enveloppes environnantes d’ électrons centraux ) occupent des positions équivalentes en translation dans le réseau cristallin. Les métaux en général ont une conductivité électrique élevée, une conductivité thermique élevée et une densité élevée. Ainsi, le transport d’énergie thermique peut être dû à deux effets:
- la migration des électrons libres
- ondes vibratoires du réseau (phonons).
Lorsque les électrons et les phonons transportent de l’énergie thermique conduisant à un transfert de chaleur par conduction dans un solide, la conductivité thermique peut être exprimée comme suit:
k = k e + k ph
La particularité des métaux en ce qui concerne leur structure est la présence de porteurs de charge, en particulier d’ électrons. Les conductivités électriques et thermiques des métaux proviennent du fait que leurs électrons externes sont délocalisés. Leur contribution à la conductivité thermique est appelée conductivité thermique électronique, ke. En fait, dans les métaux purs tels que l’or, l’argent, le cuivre et l’aluminium, le courant thermique associé au flux d’électrons dépasse de loin une petite contribution due au flux de phonons. En revanche, pour les alliages, la contribution de kph à k n’est plus négligeable.
Conductivité thermique des non-métaux
 Pour les solides non métalliques, k est déterminé principalement par kph, qui augmente à mesure que la fréquence des interactions entre les atomes et le réseau diminue. En fait, la conduction thermique du réseau est le mécanisme de conduction thermique dominant dans les non-métaux, sinon le seul. Dans les solides, les atomes vibrent autour de leurs positions d’équilibre (réseau cristallin). Les vibrations des atomes ne sont pas indépendantes les unes des autres, mais sont assez fortement couplées avec les atomes voisins. La régularité de la disposition du réseau a un effet important sur kph, avec des matériaux cristallins (bien ordonnés) comme le quartz ayant une conductivité thermique plus élevée que les matériaux amorphes comme le verre. A des températures suffisamment élevées kph ∝ 1/T.
Pour les solides non métalliques, k est déterminé principalement par kph, qui augmente à mesure que la fréquence des interactions entre les atomes et le réseau diminue. En fait, la conduction thermique du réseau est le mécanisme de conduction thermique dominant dans les non-métaux, sinon le seul. Dans les solides, les atomes vibrent autour de leurs positions d’équilibre (réseau cristallin). Les vibrations des atomes ne sont pas indépendantes les unes des autres, mais sont assez fortement couplées avec les atomes voisins. La régularité de la disposition du réseau a un effet important sur kph, avec des matériaux cristallins (bien ordonnés) comme le quartz ayant une conductivité thermique plus élevée que les matériaux amorphes comme le verre. A des températures suffisamment élevées kph ∝ 1/T.
Les quanta du champ vibrationnel du cristal sont appelés «phonons». Un phonon est une excitation collective dans un arrangement périodique et élastique d’atomes ou de molécules dans la matière condensée, comme les solides et certains liquides. Les phonons jouent un rôle majeur dans de nombreuses propriétés physiques de la matière condensée, comme la conductivité thermique et la conductivité électrique. En fait, pour les solides cristallins non métalliques tels que le diamant, kph peut être assez élevé, dépassant les valeurs de k associées à de bons conducteurs, tels que l’aluminium. En particulier, le diamant a la dureté et la conductivité thermique les plus élevées (k = 1000 W/mK) de tous les matériaux en vrac.
Conductivité thermique des liquides et des gaz
En physique, un fluide est une substance qui se déforme (s’écoule) continuellement sous une contrainte de cisaillement appliquée. Les fluides sont un sous-ensemble des phases de la matière et comprennent les liquides, les gaz, les plasmas et, dans une certaine mesure, les solides plastiques. Parce que l’espacement intermoléculaire est beaucoup plus grand et que le mouvement des molécules est plus aléatoire pour l’état fluide que pour l’état solide, le transport d’énergie thermique est moins efficace. La conductivité thermique des gaz et des liquides est donc généralement plus faible que celle des solides. Dans les liquides, la conduction thermique est causée par la diffusion atomique ou moléculaire. Dans les gaz, la conduction thermique est causée par la diffusion de molécules du niveau d’énergie supérieur au niveau inférieur.
Conductivité thermique des gaz
 L’effet de la température, de la pression et des espèces chimiques sur la conductivité thermique d’un gaz peut être expliqué en termes de théorie cinétique des gaz. L’air et les autres gaz sont généralement de bons isolants, en l’absence de convection. Par conséquent, de nombreux matériaux isolants (par exemple le polystyrène) fonctionnent simplement en ayant un grand nombre de poches remplies de gaz qui empêchent la convection à grande échelle. L’alternance de la poche de gaz et du matériau solide fait que la chaleur doit être transférée à travers de nombreuses interfaces provoquant une diminution rapide du coefficient de transfert de chaleur.
L’effet de la température, de la pression et des espèces chimiques sur la conductivité thermique d’un gaz peut être expliqué en termes de théorie cinétique des gaz. L’air et les autres gaz sont généralement de bons isolants, en l’absence de convection. Par conséquent, de nombreux matériaux isolants (par exemple le polystyrène) fonctionnent simplement en ayant un grand nombre de poches remplies de gaz qui empêchent la convection à grande échelle. L’alternance de la poche de gaz et du matériau solide fait que la chaleur doit être transférée à travers de nombreuses interfaces provoquant une diminution rapide du coefficient de transfert de chaleur.
La conductivité thermique des gaz est directement proportionnelle à la densité du gaz, à la vitesse moléculaire moyenne, et surtout au libre parcours moyen de la molécule. Le libre parcours moyen dépend également du diamètre de la molécule, les molécules plus grosses étant plus susceptibles de subir des collisions que les petites molécules, qui est la distance moyenne parcourue par un vecteur d’énergie (une molécule) avant de subir une collision. Les gaz légers, tels que l’hydrogène et l’hélium, ont généralement une conductivité thermique élevée. Les gaz denses tels que le xénon et le dichlorodifluorométhane ont une faible conductivité thermique.
En général, la conductivité thermique des gaz augmente avec l’augmentation de la température.
Conductivité thermique des liquides
Comme cela a été écrit, dans les liquides, la conduction thermique est causée par la diffusion atomique ou moléculaire, mais les mécanismes physiques pour expliquer la conductivité thermique des liquides ne sont pas bien compris. Les liquides ont tendance à avoir une meilleure conductivité thermique que les gaz, et la capacité de s’écouler rend un liquide approprié pour éliminer l’excès de chaleur des composants mécaniques. La chaleur peut être évacuée en canalisant le liquide à travers un échangeur de chaleur. Les réfrigérants utilisés dans les réacteurs nucléaires comprennent de l’eau ou des métaux liquides, tels que le sodium ou le plomb.
La conductivité thermique des liquides non métalliques diminue généralement avec l’augmentation de la température.
Coefficient de dilatation thermique des matériaux
La dilatation thermique est généralement la tendance de la matière à changer ses dimensions en réponse à un changement de température. Il est généralement exprimé sous la forme d’un changement fractionnaire de longueur ou de volume par unité de changement de température. La dilatation thermique est courante pour les solides, les liquides et les gaz. Contrairement aux gaz ou aux liquides, les matériaux solides ont tendance à conserver leur forme lorsqu’ils subissent une dilatation thermique. Un coefficient de dilatation linéaire est généralement utilisé pour décrire la dilatation d’un solide, tandis qu’un coefficient de dilatation volumique est plus utile pour un liquide ou un gaz.
Le coefficient de dilatation thermique linéaire est défini comme suit:
où L est une mesure de longueur particulière et dL/dT est le taux de changement de cette dimension linéaire par unité de changement de température.
Le coefficient de dilatation thermique volumétrique est le coefficient de dilatation thermique le plus élémentaire et le plus pertinent pour les fluides. En général, les substances se dilatent ou se contractent lorsque leur température change, la dilatation ou la contraction se produisant dans toutes les directions.
Le coefficient de dilatation thermique volumétrique est défini comme suit:
où L est le volume du matériau et dV/dT est le taux de variation de ce volume par unité de changement de température.
Dans un solide ou un liquide, il existe un équilibre dynamique entre les forces de cohésion qui maintiennent les atomes ou les molécules ensemble et les conditions créées par la température. Par conséquent, des températures plus élevées impliquent une plus grande distance entre les atomes. Différents matériaux ont des forces de liaison différentes et donc des coefficients de dilatation différents. Si un solide cristallin est isométrique (a la même configuration structurelle partout), l’expansion sera uniforme dans toutes les dimensions du cristal. Pour ces matériaux, la surface et le coefficient de dilatation thermique volumétrique sont, respectivement, environ deux fois et trois fois plus grands que le coefficient de dilatation thermique linéaire (αV = 3α L). S’il n’est pas isométrique, il peut y avoir différents coefficients de dilatation pour différentes directions cristallographiques, et le cristal changera de forme à mesure que la température change.
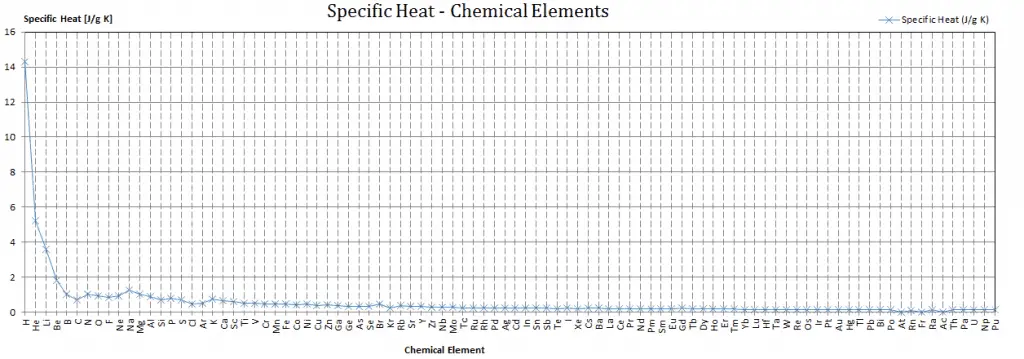
Chaleur spécifique des matériaux
La chaleur spécifique, ou capacité thermique spécifique, est une propriété liée à l’énergie interne très importante en thermodynamique. Les propriétés intensives cv et cp sont définies pour des substances compressibles pures et simples comme des dérivées partielles de l’ énergie interne u(T, v) et de l’ enthalpie h(T, p), respectivement:
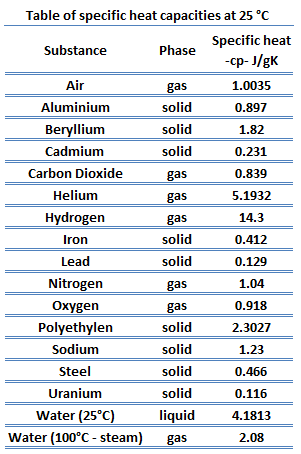 où les indices v et p désignent les variables maintenues fixes lors de la différenciation. Les propriétés cv et cp sont appelées chaleurs spécifiques (ou capacités calorifiques) car, dans certaines conditions particulières, elles relient le changement de température d’un système à la quantité d’énergie ajoutée par transfert de chaleur. Leurs unités SI sont J/kg K ou J/mol K.
où les indices v et p désignent les variables maintenues fixes lors de la différenciation. Les propriétés cv et cp sont appelées chaleurs spécifiques (ou capacités calorifiques) car, dans certaines conditions particulières, elles relient le changement de température d’un système à la quantité d’énergie ajoutée par transfert de chaleur. Leurs unités SI sont J/kg K ou J/mol K.
Différentes substances sont affectées à des degrés différents par l’ ajout de chaleur. Lorsqu’une quantité donnée de chaleur est ajoutée à différentes substances, leurs températures augmentent de différentes quantités.
La capacité calorifique est une propriété extensive de la matière, c’est-à-dire qu’elle est proportionnelle à la taille du système. La capacité thermique C a l’unité d’énergie par degré ou d’énergie par kelvin. Lors de l’expression du même phénomène en tant que propriété intensive, la capacité thermique est divisée par la quantité de substance, de masse ou de volume, ainsi la quantité est indépendante de la taille ou de l’étendue de l’échantillon.
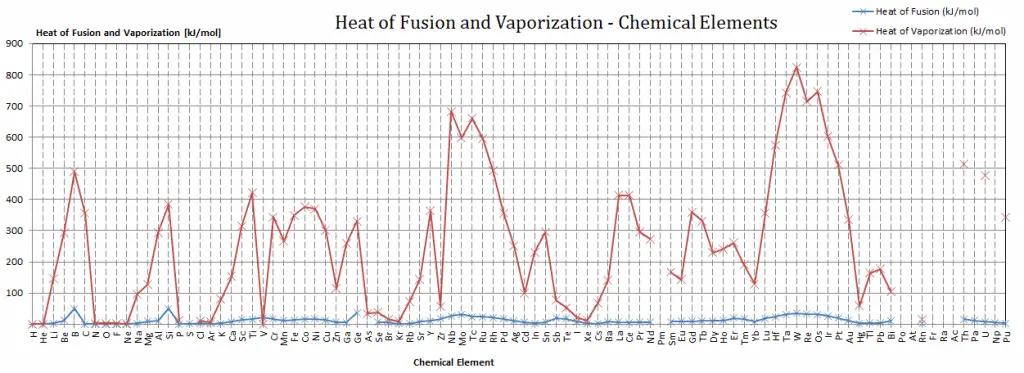
Chaleur latente de vaporisation des matériaux
En général, lorsqu’un matériau change de phase de solide à liquide ou de liquide à gaz, une certaine quantité d’énergie est impliquée dans ce changement de phase. En cas de changement de phase liquide à gaz, cette quantité d’énergie est connue sous le nom d’ enthalpie de vaporisation , (symbole ∆Hvap; unité: J) également appelée chaleur (latente) de vaporisation ou chaleur d’évaporation. À titre d’exemple, voir la figure, qui décrit les transitions de phase de l’eau.
La chaleur latente est la quantité de chaleur ajoutée ou retirée d’une substance pour produire un changement de phase. Cette énergie décompose les forces attractives intermoléculaires, et doit également fournir l’énergie nécessaire pour dilater le gaz (le pΔV travail). Lorsque la chaleur latente est ajoutée, aucun changement de température ne se produit. L’enthalpie de vaporisation est fonction de la pression à laquelle cette transformation a lieu.
La température à laquelle la vaporisation (ébullition) commence à se produire pour une pression donnée est également connue sous le nom de température de saturation et dans ces conditions, un mélange de vapeur et de liquide peut exister ensemble. On peut dire que le liquide est saturé d’ énergie thermique. Tout ajout d’énergie thermique entraîne une transition de phase. Au point d’ébullition, les deux phases d’une substance, liquide et vapeur, ont des énergies libres identiques et sont donc également susceptibles d’exister. En dessous du point d’ébullition, le liquide est l’état le plus stable des deux, alors qu’au-dessus, la forme gazeuse est préférée.
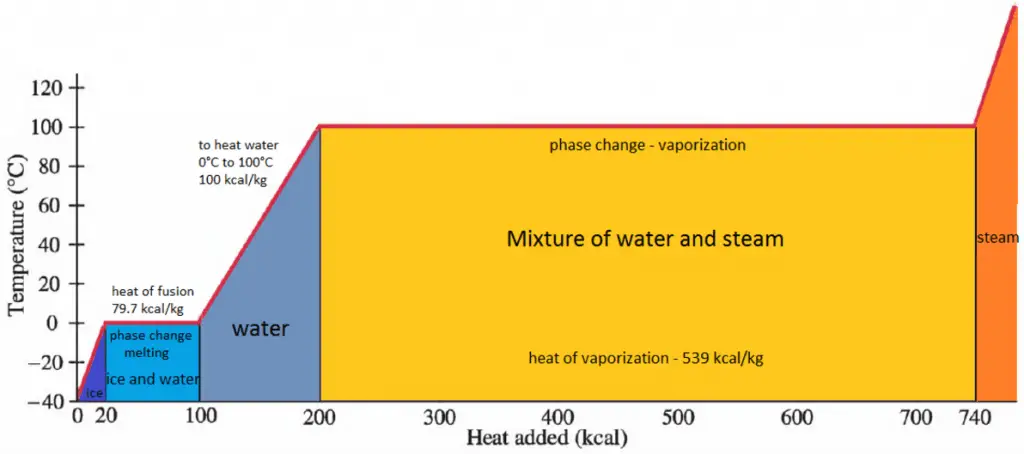
Chaleur latente de fusion des matériaux
En cas de changement de phase solide à liquide, le changement d’ enthalpie nécessaire pour changer son état est appelé enthalpie de fusion, (symbole ∆Hfus; unité: J) également appelée chaleur (latente) de fusion . La chaleur latente est la quantité de chaleur ajoutée ou retirée d’une substance pour produire un changement de phase. Cette énergie décompose les forces d’attraction intermoléculaires et doit également fournir l’énergie nécessaire à l’expansion du système (le travail pΔV).
La phase liquide a une énergie interne plus élevée que la phase solide. Cela signifie que de l’énergie doit être fournie à un solide pour le faire fondre et que de l’énergie est libérée d’un liquide lorsqu’il gèle, car les molécules du liquide subissent des forces intermoléculaires plus faibles et ont donc une énergie potentielle plus élevée (une sorte d’énergie de dissociation des liaisons pour les forces intermoléculaires).
La température à laquelle la transition de phase se produit est le point de fusion. Le point de fusion définit également une condition dans laquelle le solide et le liquide peuvent exister en équilibre. L’ajout d’une chaleur convertira le solide en liquide sans changement de température. Au point de fusion, les deux phases d’une substance, liquide et vapeur, ont des énergies libres identiques et sont donc également susceptibles d’exister. En dessous du point de fusion, le solide est l’état le plus stable des deux, alors qu’au-dessus, la forme liquide est préférée. Le point de fusion d’une substance dépend de la pression et est généralement spécifié à la pression standard. Considérée comme la température du passage inverse du liquide au solide, elle est appelée point de congélation ou point de cristallisation.
Emissivité des matériaux
L’ émissivité, ε, de la surface d’un matériau est son efficacité à émettre de l’énergie sous forme de rayonnement thermique et varie entre 0,0 et 1,0.
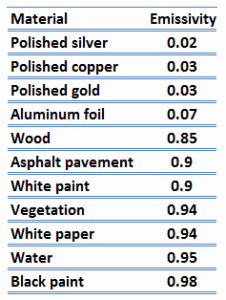 Par définition, un corps noir en équilibre thermique a une émissivité de ε = 1.0. Les objets réels ne dégagent pas autant de chaleur qu’un corps noir parfait. Ils émettent moins de chaleur qu’un corps noir et sont donc appelés corps gris. Pour tenir compte du fait que les objets réels sont des corps gris, la loi de Stefan-Boltzmann doit inclure l’ émissivité. Quantitativement, l’ émissivité est le rapport du rayonnement thermique d’une surface au rayonnement d’une surface noire idéale à la même température que celle donnée par la loi de Stefan-Boltzmann. L’émissivité est simplement un facteur par lequel nous multiplions le transfert de chaleur du corps noir pour tenir compte du fait que le corps noir est le cas idéal.
Par définition, un corps noir en équilibre thermique a une émissivité de ε = 1.0. Les objets réels ne dégagent pas autant de chaleur qu’un corps noir parfait. Ils émettent moins de chaleur qu’un corps noir et sont donc appelés corps gris. Pour tenir compte du fait que les objets réels sont des corps gris, la loi de Stefan-Boltzmann doit inclure l’ émissivité. Quantitativement, l’ émissivité est le rapport du rayonnement thermique d’une surface au rayonnement d’une surface noire idéale à la même température que celle donnée par la loi de Stefan-Boltzmann. L’émissivité est simplement un facteur par lequel nous multiplions le transfert de chaleur du corps noir pour tenir compte du fait que le corps noir est le cas idéal.
La surface d’un corps noir émet un rayonnement thermique à raison d’environ 448 watts par mètre carré à température ambiante (25 °C, 298,15 K). Les objets réels avec des émissivités inférieures à 1,0 (par exemple un fil de cuivre) émettent un rayonnement à des taux proportionnellement inférieurs (par exemple 448 x 0,03 = 13,4 W/m2). L’émissivité joue un rôle important dans les problèmes de transfert de chaleur. Par exemple, les capteurs solaires intègrent des surfaces sélectives à très faible émissivité. Ces collecteurs gaspillent très peu d’énergie solaire par émission de rayonnement thermique.
Une autre propriété de rayonnement importante d’une surface est son pouvoir d’absorption, α, qui est la fraction de l’énergie de rayonnement incidente sur une surface qui est absorbée par la surface. Comme l’émissivité, la valeur de l’absorptivité est comprise entre 0 < α < 1.
En général, l’ absorptivité et l’ émissivité sont interconnectées par la loi de Kirchhoff sur le rayonnement thermique, qui stipule:
Pour un corps quelconque émettant et absorbant un rayonnement thermique en équilibre thermodynamique, l’émissivité est égale à l’absorptivité.
émissivité ε = absorptivité α
A noter que le rayonnement visible occupe une bande très étroite du spectre de 0,4 à 0,76 nm, on ne peut porter aucun jugement sur la noirceur d’une surface sur la base d’observations visuelles. Par exemple, considérez un papier blanc qui réfléchit la lumière visible et qui apparaît donc blanc. En revanche il est essentiellement noir pour les rayonnements infrarouges (absorptivité α = 0,94) car ils absorbent fortement les rayonnements de grande longueur d’onde.
Voir aussi: Couverture thermique
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Propriétés thermiques des matériaux, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.