Une liaison chimique est une attraction durable entre ces atomes, ions ou molécules qui permet la formation de composés chimiques. La liaison peut résulter de la force électrostatique d’attraction entre des ions chargés de manière opposée comme dans les liaisons ioniques ou par le partage d’électrons comme dans les liaisons covalentes. Par conséquent, la force électromagnétique joue un rôle majeur dans la détermination des propriétés internes de la plupart des objets rencontrés dans la vie quotidienne.
Une liaison covalente
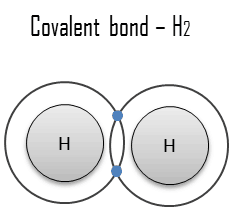 Une liaison covalente est une liaison chimique formée par des électrons partagés. Les électrons de Valence sont partagés lorsqu’un atome a besoin d’électrons pour compléter sa coque externe et peut partager ces électrons avec son voisin. Les électrons font alors partie des deux atomes et les deux coquilles sont remplies. Ces paires d’électrons sont appelées paires partagées ou paires de liaison, et l’équilibre stable des forces attractives et répulsives entre les atomes, lorsqu’ils partagent des électrons, est appelé liaison covalente.
Une liaison covalente est une liaison chimique formée par des électrons partagés. Les électrons de Valence sont partagés lorsqu’un atome a besoin d’électrons pour compléter sa coque externe et peut partager ces électrons avec son voisin. Les électrons font alors partie des deux atomes et les deux coquilles sont remplies. Ces paires d’électrons sont appelées paires partagées ou paires de liaison, et l’équilibre stable des forces attractives et répulsives entre les atomes, lorsqu’ils partagent des électrons, est appelé liaison covalente.
Le type le plus simple et le plus courant est une liaison simple dans laquelle deux atomes partagent deux électrons. D’autres types comprennent la double liaison (par exemple H2C = CH2), la triple liaison, les liaisons à un et trois électrons, la liaison à deux électrons à trois centres et la liaison à quatre électrons à trois centres.
La covalence est la plus grande entre des atomes d’ électronégativités similaires. Ainsi, la liaison covalente n’exige pas nécessairement que les deux atomes soient des mêmes éléments, seulement qu’ils soient d’ électronégativité comparable (c’est-à-dire des éléments proches les uns des autres dans le tableau périodique). Il n’y a pas de valeur précise qui distingue la liaison ionique de la liaison covalente, mais une différence d’électronégativité supérieure à 1,7 est susceptible d’être ionique tandis qu’une différence inférieure à 1,7 est susceptible d’être covalente.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Liaison covalente, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.