Une liaison chimique est une attraction durable entre ces atomes, ions ou molécules qui permet la formation de composés chimiques. La liaison peut résulter de la force électrostatique d’attraction entre des ions chargés de manière opposée comme dans les liaisons ioniques ou par le partage d’électrons comme dans les liaisons covalentes. Par conséquent, la force électromagnétique joue un rôle majeur dans la détermination des propriétés internes de la plupart des objets rencontrés dans la vie quotidienne.
Liaison ionique
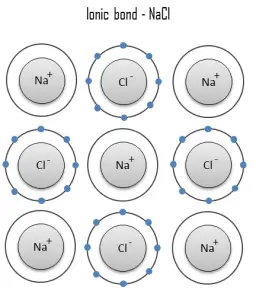 Une liaison ionique est une liaison chimique, dans laquelle un ou plusieurs électrons sont entièrement transférés d’un atome d’un élément à l’atome de l’autre, et les éléments sont maintenus ensemble par la force d’attraction due à la polarité opposée de la charge. Ce type de liaison chimique est typique entre des éléments à grande différence d’électronégativité (c’est-à-dire des éléments situés aux extrémités horizontales du tableau périodique). Une liaison ionique se trouve toujours dans les composés composés d’éléments métalliques et non métalliques. Il n’y a pas de valeur précise qui distingue la liaison ionique de la liaison covalente, mais une différence d’ électronégativité supérieure à 1,7 est susceptible d’être ionique tandis qu’une différence inférieure à 1,7 est susceptible d’être covalente.
Une liaison ionique est une liaison chimique, dans laquelle un ou plusieurs électrons sont entièrement transférés d’un atome d’un élément à l’atome de l’autre, et les éléments sont maintenus ensemble par la force d’attraction due à la polarité opposée de la charge. Ce type de liaison chimique est typique entre des éléments à grande différence d’électronégativité (c’est-à-dire des éléments situés aux extrémités horizontales du tableau périodique). Une liaison ionique se trouve toujours dans les composés composés d’éléments métalliques et non métalliques. Il n’y a pas de valeur précise qui distingue la liaison ionique de la liaison covalente, mais une différence d’ électronégativité supérieure à 1,7 est susceptible d’être ionique tandis qu’une différence inférieure à 1,7 est susceptible d’être covalente.
La liaison ionique conduit à séparer les ions positifs et négatifs. Dans le processus, tous les atomes acquièrent des configurations de gaz stables ou inertes (c’est-à-dire des coquilles orbitales complètement remplies) et, en plus, une charge électrique – c’est-à-dire qu’ils deviennent des ions. Par exemple, le sel de table courant est le chlorure de sodium. Le chlorure de sodium (NaCl) est le matériau ionique classique. Un atome de sodium peut assumer la structure électronique du néon par un transfert de son électron de valence 3s à un atome de chlore. Après un tel transfert, l’ion chlore acquiert une charge nette négative, une configuration électronique identique à celle de l’argon ; il est également plus grand que l’atome de chlore. Ces ions sont ensuite attirés les uns vers les autres dans un rapport 1:1 pour former du chlorure de sodium (NaCl).
Na + Cl → Na+ + Cl – → NaCl
Les composés ioniques conduisent l’électricité lorsqu’ils sont fondus ou en solution, généralement sous forme solide. Les composés ioniques ont généralement un point de fusion élevé, en fonction de la charge des ions qui les composent. Plus les charges sont élevées, plus les forces de cohésion sont fortes et plus le point de fusion est élevé. Ils ont également tendance à être solubles dans l’eau; plus les forces de cohésion sont fortes, plus la solubilité est faible.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 1 et 2. Janvier 1993.
- Département américain de l’énergie, science des matériaux. DOE Fundamentals Handbook, Volume 2 et 2. Janvier 1993.
- William D. Callister, David G. Rethwisch. Science et génie des matériaux : une introduction 9e édition, Wiley ; 9 édition (4 décembre 2013), ISBN-13 : 978-1118324578.
- En ligneEberhart, Mark (2003). Pourquoi les choses se cassent : Comprendre le monde par la manière dont il se décompose. Harmonie. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introduction à la thermodynamique des matériaux (4e éd.). Éditions Taylor et Francis. ISBN 978-1-56032-992-3.
- Gonzalez-Viñas, W. & Mancini, HL (2004). Une introduction à la science des matériaux. Presse universitaire de Princeton. ISBN 978-0-691-07097-1
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Matériaux: ingénierie, science, traitement et conception (1ère éd.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introduction au génie nucléaire, 3e éd., Prentice-Hall, 2001, ISBN : 0-201-82498-1.
Nous espérons que cet article, Ionic Bond, vous aidera. Si oui, donnez-nous un like dans la barre latérale. L’objectif principal de ce site Web est d’aider le public à apprendre des informations intéressantes et importantes sur les matériaux et leurs propriétés.