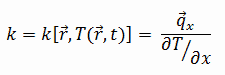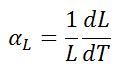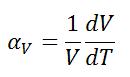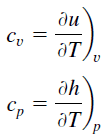Las propiedades térmicas de los materiales se refieren a la respuesta de los materiales a los cambios de thermodynamics/thermodynamic-properties/what-is-temperature-physics/»>temperatura y a la aplicación de calor. A medida que un sólido absorbe thermodynamics/what-is-energy-physics/»>energía en forma de calor, su temperatura aumenta y sus dimensiones aumentan. Pero los diferentes materiales reaccionan a la aplicación de calor de manera diferente.
La capacidad calorífica, la expansión térmica y la conductividad térmica son propiedades que a menudo son críticas en el uso práctico de sólidos.
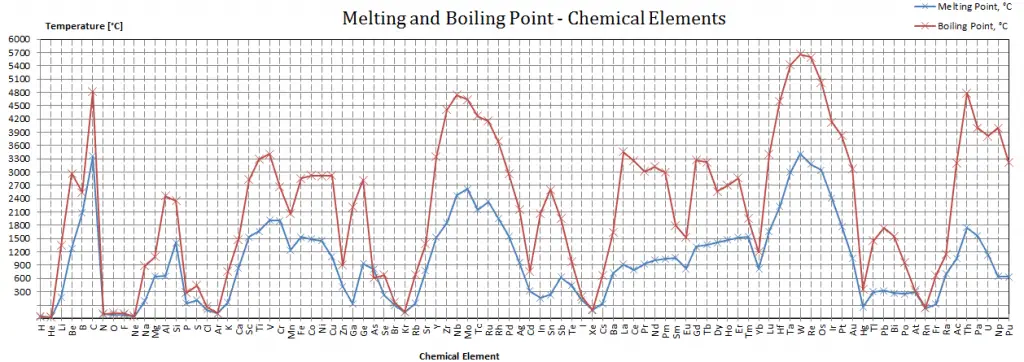
Punto de fusión: punto de ebullición de los materiales
Tenga en cuenta que estos puntos están asociados con la presión atmosférica estándar.
Punto de fusion
Ver también: Puntos de fusión – Tabla periódica
En general, la fusión es un cambio de fase de una sustancia de la fase sólida a la líquida. El punto de fusión de una sustancia es la temperatura a la que se produce este cambio de fase. El punto de fusión también define una condición en la que el sólido y el líquido pueden existir en equilibrio. Agregar calor convertirá el sólido en líquido sin cambios de temperatura. En el punto de fusión, las dos fases de una sustancia, líquido y vapor, tienen energías libres idénticas y, por lo tanto, es igualmente probable que existan. Por debajo del punto de fusión, el sólido es el estado más estable de los dos, mientras que por encima se prefiere la forma líquida. El punto de fusión de una sustancia depende de la presión y generalmente se especifica a presión estándar. Cuando se considera como la temperatura del cambio inverso de líquido a sólido, se denomina punto de congelación o punto de cristalización.
Ver también: depresión del punto de fusión
La primera teoría que explica el mecanismo de fusión a granel fue propuesta por Lindemann, quien utilizó la vibración de los átomos en el cristal para explicar la transición de fusión. Los sólidos son similares a los líquidos en que ambos son estados condensados, con partículas que están mucho más juntas que las de un gas. Los átomos de un sólido están estrechamente unidos entre sí, ya sea en una red geométrica regular (sólidos cristalinos, que incluyen metales y hielo ordinario) o irregularmente (un sólido amorfo como el vidrio de ventana común), y por lo general tienen poca energía. El movimiento de átomos, iones o moléculas individuales en un sólido está restringido al movimiento vibratorio alrededor de un punto fijo. A medida que se calienta un sólido, sus partículas vibran más rápidamente a medida que el sólido absorbe energía cinética. En algún momento, la amplitud de la vibración se vuelve tan grande que los átomos comienzan a invadir el espacio de sus vecinos más cercanos y los perturban y se inicia el proceso de fusión. El punto de fusión es la temperatura a la que las vibraciones disruptivas de las partículas del sólido superan las fuerzas de atracción que operan dentro del sólido.
Al igual que con los puntos de ebullición, el punto de fusión de un sólido depende de la fuerza de esas fuerzas atractivas. Por ejemplo, el cloruro de sodio (NaCl) es un compuesto iónico que consta de una multitud de enlaces iónicos fuertes. El cloruro de sodio se funde a 801°C. Por otro lado, el hielo (H2O sólido) es un compuesto molecular cuyas moléculas se mantienen unidas por enlaces de hidrógeno, lo que constituye un claro ejemplo de interacción entre dos dipolos permanentes. Aunque los enlaces de hidrógeno son las fuerzas intermoleculares más fuertes, la fuerza de los enlaces de hidrógeno es mucho menor que la de los enlaces iónicos. El punto de fusión del hielo es de 0°C.
Los enlaces covalentes a menudo dan como resultado la formación de pequeñas colecciones de átomos mejor conectados llamados moléculas, que en sólidos y líquidos están unidos a otras moléculas por fuerzas que a menudo son mucho más débiles que los enlaces covalentes que mantienen unidas las moléculas internamente. Estos enlaces intermoleculares débiles dan a las sustancias moleculares orgánicas, como ceras y aceites, su carácter de masa blanda y sus puntos de fusión bajos (en los líquidos, las moléculas deben dejar de tener un contacto más estructurado u orientado entre sí).
Punto de ebullición
Ver también: Puntos de ebullición – Tabla periódica
En general, la ebullición es un cambio de fase de una sustancia de la fase líquida a la fase gaseosa. El punto de ebullición de una sustancia es la temperatura a la que se produce este cambio de fase (ebullición o vaporización). La temperatura a la que comienza a producirse la vaporización (ebullición) para una presión determinada también se conoce como temperatura de saturación y, en estas condiciones, puede coexistir una mezcla de vapor y líquido. Se puede decir que el líquido está saturado de energía térmica. Cualquier adición de energía térmica da como resultado una transición de fase. En el punto de ebullición las dos fases de una sustancia, líquido y vapor, tienen energías libres idénticas y, por lo tanto, es igualmente probable que existan. Por debajo del punto de ebullición, el líquido es el estado más estable de los dos, mientras que por encima se prefiere la forma gaseosa. La presión a la que comienza a producirse la vaporización (ebullición) para una temperatura determinada se denomina presión de saturación. Cuando se considera como la temperatura del cambio inverso de vapor a líquido, se denomina punto de condensación.
Como puede verse, el punto de ebullición de un líquido varía dependiendo de la presión ambiental circundante. Un líquido en vacío parcial tiene un punto de ebullición más bajo que cuando ese líquido está a presión atmosférica. Un líquido a alta presión tiene un punto de ebullición más alto que cuando ese líquido está a presión atmosférica. Por ejemplo, el agua hierve a 100°C (212°F) al nivel del mar, pero a 93,4°C (200,1°F) a 1900 metros (6,233 pies) de altitud. Por otro lado, el agua hierve a 350°C (662°F) a 16,5 MPa (presión típica de los PWR).
En la tabla periódica de elementos, el elemento con el punto de ebullición más bajo es el helio. Tanto los puntos de ebullición del renio como del tungsteno superan los 5000 K a presión estándar. Dado que es difícil medir temperaturas extremas con precisión sin sesgo, se ha citado en la bibliografía que ambas tienen el punto de ebullición más alto.
Conductividad térmica de materiales
Las características de transferencia de calor de un material sólido se miden mediante una propiedad llamada conductividad térmica, k (o λ), medida en W/mK. Es una medida de la capacidad de una sustancia para transferir calor a través de un material por conducción. Tenga en cuenta que la ley de Fourier se aplica a toda la materia, independientemente de su estado (sólido, líquido o gas), por lo tanto, también se define para líquidos y gases.
La conductividad térmica de la mayoría de los líquidos y sólidos varía con la temperatura. Para los vapores, también depende de la presión. En general:
La mayoría de los materiales son casi homogéneos, por lo que normalmente podemos escribir k = k (T). Se asocian definiciones similares con las conductividades térmicas en las direcciones y y z (ky, kz), pero para un material isótropo, la conductividad térmica es independiente de la dirección de transferencia, kx = ky = kz = k.
Conductividad térmica de metales
- la migración de electrones libres
- ondas vibratorias de celosía (fonones)
Cuando los electrones y fonones transportan energía térmica que conduce a la transferencia de calor por conducción en un sólido, la conductividad térmica se puede expresar como:
k = k e + k ph
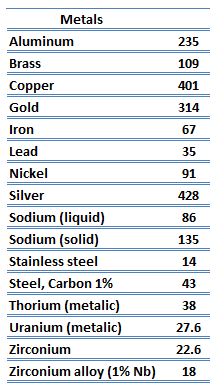 Los metales son sólidos y, como tales, poseen una estructura cristalina donde los iones (núcleos con sus capas circundantes de electrones centrales) ocupan posiciones traslacionalmente equivalentes en la red cristalina. Los metales en general tienen alta conductividad eléctrica, alta conductividad térmica y alta densidad. En consecuencia, el transporte de energía térmica puede deberse a dos efectos:
Los metales son sólidos y, como tales, poseen una estructura cristalina donde los iones (núcleos con sus capas circundantes de electrones centrales) ocupan posiciones traslacionalmente equivalentes en la red cristalina. Los metales en general tienen alta conductividad eléctrica, alta conductividad térmica y alta densidad. En consecuencia, el transporte de energía térmica puede deberse a dos efectos:
- la migración de electrones libres
- ondas vibratorias de celosía (fonones).
Cuando los electrones y fonones transportan energía térmica que conduce a la transferencia de calor por conducción en un sólido, la conductividad térmica se puede expresar como:
k = ke + kph
La característica única de los metales en lo que respecta a su estructura es la presencia de portadores de carga, específicamente electrones. Las conductividades eléctricas y térmicas de los metales se originan por el hecho de que sus electrones externos están deslocalizados. Su contribución a la conductividad térmica se denomina conductividad térmica electrónica, ke. De hecho, en metales puros como el oro, la plata, el cobre y el aluminio, la corriente de calor asociada con el flujo de electrones supera con creces una pequeña contribución debida al flujo de fonones. Por el contrario, para las aleaciones, la contribución de k ph a k ya no es despreciable.
Conductividad térmica de no metales
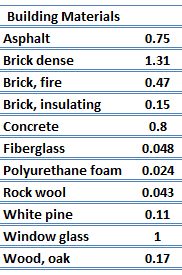 Para los sólidos no metálicos, k está determinado principalmente por kph, que aumenta a medida que disminuye la frecuencia de interacciones entre los átomos y la red. De hecho, la conducción térmica reticular es el mecanismo de conducción térmica dominante en los no metales, si no el único. En los sólidos, los átomos vibran alrededor de sus posiciones de equilibrio (red cristalina). Las vibraciones de los átomos no son independientes entre sí, sino que están fuertemente acopladas con los átomos vecinos. La regularidad de la disposición de la celosía tiene un efecto importante en el kph, con materiales cristalinos (bien ordenados) como el cuarzo que tiene una conductividad térmica más alta que los materiales amorfos como el vidrio. A temperaturas suficientemente altas kph ∝ 1/T.
Para los sólidos no metálicos, k está determinado principalmente por kph, que aumenta a medida que disminuye la frecuencia de interacciones entre los átomos y la red. De hecho, la conducción térmica reticular es el mecanismo de conducción térmica dominante en los no metales, si no el único. En los sólidos, los átomos vibran alrededor de sus posiciones de equilibrio (red cristalina). Las vibraciones de los átomos no son independientes entre sí, sino que están fuertemente acopladas con los átomos vecinos. La regularidad de la disposición de la celosía tiene un efecto importante en el kph, con materiales cristalinos (bien ordenados) como el cuarzo que tiene una conductividad térmica más alta que los materiales amorfos como el vidrio. A temperaturas suficientemente altas kph ∝ 1/T.
Los cuantos del campo vibratorio del cristal se conocen como » fonones «. Un fonón es una excitación colectiva en una disposición elástica periódica de átomos o moléculas en materia condensada, como sólidos y algunos líquidos. Los fonones juegan un papel importante en muchas de las propiedades físicas de la materia condensada, como la conductividad térmica y la conductividad eléctrica. De hecho, para sólidos cristalinos no metálicos como el diamante, kph puede ser bastante grande, excediendo los valores de k asociados con buenos conductores, como el aluminio. En particular, el diamante tiene la mayor dureza y conductividad térmica (k = 1000 W/mK) de cualquier material a granel.
Conductividad térmica de líquidos y gases
En física, un fluido es una sustancia que se deforma (fluye) continuamente bajo un esfuerzo cortante aplicado. Los fluidos son un subconjunto de las fases de la materia e incluyen líquidos, gases, plasmas y, hasta cierto punto, sólidos plásticos. Debido a que el espaciamiento intermolecular es mucho mayor y el movimiento de las moléculas es más aleatorio para el estado fluido que para el estado sólido, el transporte de energía térmica es menos efectivo. La conductividad térmica de gases y líquidos es, por tanto, generalmente más pequeña que la de sólidos. En los líquidos, la conducción térmica se produce por difusión atómica o molecular. En los gases, la conducción térmica es causada por la difusión de moléculas desde el nivel de energía más alto al nivel más bajo.
Conductividad térmica de gases
 El efecto de la temperatura, la presión y las especies químicas sobre la conductividad térmica de un gas puede explicarse en términos de la teoría cinética de los gases. El aire y otros gases son generalmente buenos aislantes, en ausencia de convección. Por lo tanto, muchos materiales aislantes (por ejemplo, poliestireno) funcionan simplemente al tener una gran cantidad de bolsas llenas de gas que evitan la convección a gran escala. La alternancia de la bolsa de gas y el material sólido hace que el calor deba transferirse a través de muchas interfaces, lo que provoca una rápida disminución del coeficiente de transferencia de calor.
El efecto de la temperatura, la presión y las especies químicas sobre la conductividad térmica de un gas puede explicarse en términos de la teoría cinética de los gases. El aire y otros gases son generalmente buenos aislantes, en ausencia de convección. Por lo tanto, muchos materiales aislantes (por ejemplo, poliestireno) funcionan simplemente al tener una gran cantidad de bolsas llenas de gas que evitan la convección a gran escala. La alternancia de la bolsa de gas y el material sólido hace que el calor deba transferirse a través de muchas interfaces, lo que provoca una rápida disminución del coeficiente de transferencia de calor.
La conductividad térmica de los gases es directamente proporcional a la densidad del gas, la velocidad molecular media y especialmente a la trayectoria libre media de la molécula. El camino libre medio también depende del diámetro de la molécula, y las moléculas más grandes tienen más probabilidades de experimentar colisiones que las moléculas pequeñas, que es la distancia promedio recorrida por un portador de energía (una molécula) antes de experimentar una colisión. Los gases ligeros, como el hidrógeno y el helio, suelen tener una alta conductividad térmica. Los gases densos como el xenón y el diclorodifluorometano tienen baja conductividad térmica.
En general, la conductividad térmica de los gases aumenta al aumentar la temperatura.
Conductividad térmica de líquidos
Como se escribió, en los líquidos, la conducción térmica es causada por difusión atómica o molecular, pero no se conocen bien los mecanismos físicos para explicar la conductividad térmica de los líquidos. Los líquidos tienden a tener una mejor conductividad térmica que los gases, y la capacidad de fluir hace que un líquido sea adecuado para eliminar el exceso de calor de los componentes mecánicos. El calor se puede eliminar canalizando el líquido a través de un intercambiador de calor. Los refrigerantes utilizados en los reactores nucleares incluyen agua o metales líquidos, como sodio o plomo.
La conductividad térmica de los líquidos no metálicos generalmente disminuye al aumentar la temperatura.
Coeficiente de expansión térmica de materiales
La expansión térmica es generalmente la tendencia de la materia a cambiar sus dimensiones en respuesta a un cambio de temperatura. Por lo general, se expresa como un cambio fraccionario en longitud o volumen por cambio de temperatura unitario. La expansión térmica es común para sólidos, líquidos y gases. A diferencia de los gases o líquidos, los materiales sólidos tienden a mantener su forma cuando experimentan expansión térmica. Un coeficiente de expansión lineal se emplea generalmente para describir la expansión de un sólido, mientras que un coeficiente de expansión de volumen es más útil para un líquido o un gas.
El coeficiente de expansión térmica lineal se define como:
donde L es una medida de longitud particular y dL/dT es la tasa de cambio de esa dimensión lineal por unidad de cambio de temperatura.
El coeficiente de expansión térmica volumétrica es el coeficiente de expansión térmica más básico y el más relevante para los fluidos. En general, las sustancias se expanden o contraen cuando cambia su temperatura, y la expansión o contracción ocurre en todas las direcciones.
El coeficiente de expansión térmica volumétrica se define como:
donde L es el volumen del material y dV/dT es la tasa de cambio de ese volumen por unidad de cambio de temperatura.
En un sólido o líquido, existe un equilibrio dinámico entre las fuerzas cohesivas que mantienen unidos los átomos o moléculas y las condiciones creadas por la temperatura. Por lo tanto, temperaturas más altas implican una mayor distancia entre los átomos. Los diferentes materiales tienen diferentes fuerzas de unión y, por lo tanto, diferentes coeficientes de expansión. Si un sólido cristalino es isométrico (tiene la misma configuración estructural en todas partes), la expansión será uniforme en todas las dimensiones del cristal. Para estos materiales, el área y el coeficiente de expansión térmica volumétrica son, respectivamente, aproximadamente dos y tres veces mayores que el coeficiente de expansión térmica lineal (αV = 3αL). Si no es isométrico, puede haber diferentes coeficientes de expansión para diferentes direcciones cristalográficas, y el cristal cambiará de forma a medida que cambia la temperatura.
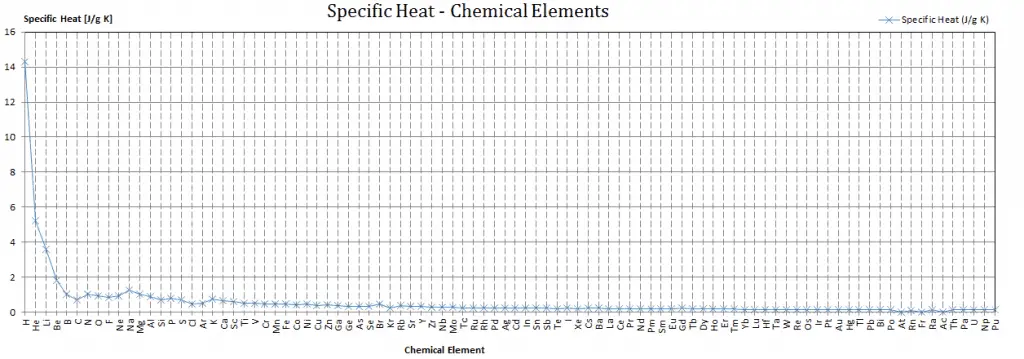
Calor específico de materiales
El calor específico, o capacidad calorífica específica, es una propiedad relacionada con la energía interna que es muy importante en termodinámica. Las propiedades intensivas cv y cp se definen para sustancias compresibles simples puras como derivadas parciales de la energía interna u (T, v) y la entalpía h (T, p), respectivamente:
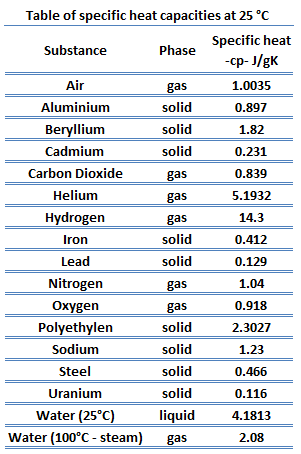 donde los subíndices v y p denotan las variables que se mantienen fijas durante la diferenciación. Las propiedades cv y cp se denominan calores específicos (o capacidades caloríficas) porque, en determinadas condiciones especiales, relacionan el cambio de temperatura de un sistema con la cantidad de energía añadida por la transferencia de calor. Sus unidades SI son J/kgK o J/molK.
donde los subíndices v y p denotan las variables que se mantienen fijas durante la diferenciación. Las propiedades cv y cp se denominan calores específicos (o capacidades caloríficas) porque, en determinadas condiciones especiales, relacionan el cambio de temperatura de un sistema con la cantidad de energía añadida por la transferencia de calor. Sus unidades SI son J/kgK o J/molK.
Diferentes sustancias se ven afectadas en diferentes magnitudes por la adición de calor. Cuando se agrega una determinada cantidad de calor a diferentes sustancias, sus temperaturas aumentan en diferentes cantidades.
La capacidad calorífica es una propiedad extensa de la materia, lo que significa que es proporcional al tamaño del sistema. La capacidad calorífica C tiene la unidad de energía por grado o energía por kelvin. Cuando se expresa el mismo fenómeno como una propiedad intensiva, la capacidad calorífica se divide por la cantidad de sustancia, masa o volumen, por lo que la cantidad es independiente del tamaño o extensión de la muestra.
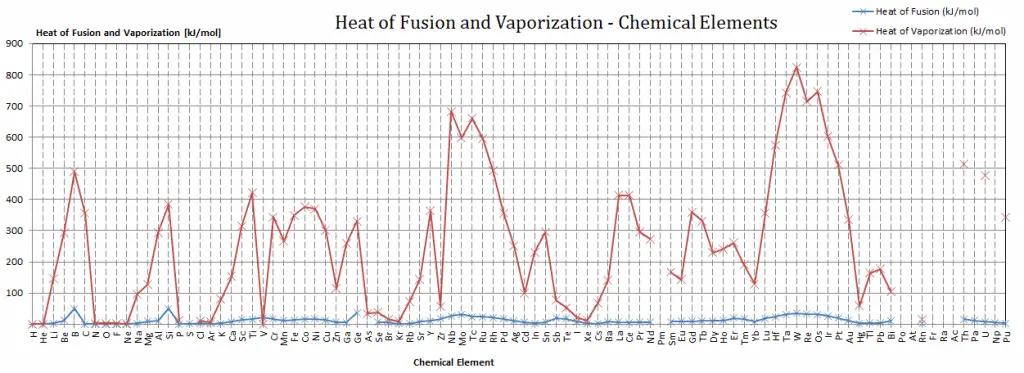
Calor latente de vaporización de materiales
En general, cuando un material cambia de fase de sólido a líquido, o de líquido a gas, una cierta cantidad de energía está involucrada en este cambio de fase. En caso de cambio de fase líquida a gaseosa, esta cantidad de energía se conoce como entalpía de vaporización, (símbolo ∆ vap; unidad: J) también conocida como calor (latente) de vaporización o calor de evaporación. Como ejemplo, vea la figura, que describe las transiciones de fase del agua.
El calor latente es la cantidad de calor que se agrega o elimina de una sustancia para producir un cambio de fase. Esta energía descompone las fuerzas de atracción intermoleculares y también debe proporcionar la energía necesaria para expandir el gas (el trabajo pΔV). Cuando se agrega calor latente, no se produce ningún cambio de temperatura. La entalpía de vaporización es función de la presión a la que tiene lugar esa transformación.
La temperatura a la que comienza a producirse la vaporización (ebullición) para una presión determinada también se conoce como temperatura de saturación y, en estas condiciones, puede coexistir una mezcla de vapor y líquido. Se puede decir que el líquido está saturado de energía térmica. Cualquier adición de energía térmica da como resultado una transición de fase. En el punto de ebullición, las dos fases de una sustancia, líquido y vapor, tienen energías libres idénticas y, por lo tanto, es igualmente probable que existan. Por debajo del punto de ebullición, el líquido es el estado más estable de los dos, mientras que por encima se prefiere la forma gaseosa.
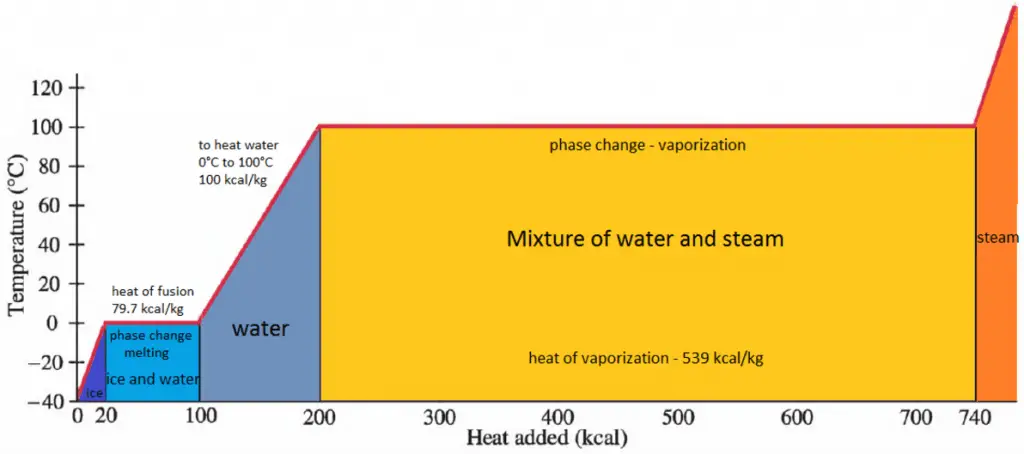
Calor latente de fusión de materiales
En caso de cambio de fase sólida a líquida, el cambio de entalpía requerido para cambiar su estado se conoce como entalpía de fusión, (símbolo ∆Hfus; unidad: J) también conocido como calor (latente) de fusión. El calor latente es la cantidad de calor que se agrega o elimina de una sustancia para producir un cambio de fase. Esta energía descompone las fuerzas de atracción intermoleculares y también debe proporcionar la energía necesaria para expandir el sistema (el trabajo pΔV).
La fase líquida tiene una energía interna más alta que la fase sólida. Esto significa que se debe suministrar energía a un sólido para derretirlo y la energía se libera de un líquido cuando se congela, porque las moléculas en el líquido experimentan fuerzas intermoleculares más débiles y, por lo tanto, tienen una energía potencial más alta (una especie de energía de enlace-disociación para fuerzas intermoleculares).
La temperatura a la que se produce la transición de fase es el punto de fusión. El punto de fusión también define una condición en la que el sólido y el líquido pueden existir en equilibrio. Agregar calor convertirá el sólido en líquido sin cambios de temperatura. En el punto de fusión, las dos fases de una sustancia, líquido y vapor, tienen energías libres idénticas y, por lo tanto, es igualmente probable que existan. Por debajo del punto de fusión, el sólido es el estado más estable de los dos, mientras que por encima se prefiere la forma líquida. El punto de fusión de una sustancia depende de la presión y generalmente se especifica a presión estándar. Cuando se considera como la temperatura del cambio inverso de líquido a sólido, se denomina punto de congelación o punto de cristalización.
Emisividad de materiales
La emisividad, ε, de la superficie de un material es su efectividad para emitir energía como radiación térmica y varía entre 0,0 y 1,0.
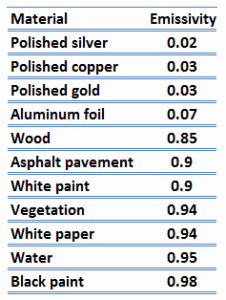 Por definición, un cuerpo negro en equilibrio térmico tiene una emisividad de ε =1,0. Los objetos reales no irradian tanto calor como un cuerpo negro perfecto. Irradian menos calor que un cuerpo negro y, por lo tanto, se denominan cuerpos grises. Para tener en cuenta el hecho de que los objetos reales son cuerpos grises, la ley de Stefan-Boltzmann debe incluir la emisividad. Cuantitativamente, la emisividad es la relación entre la radiación térmica de una superficie y la radiación de una superficie negra ideal a la misma temperatura dada por la ley de Stefan-Boltzmann. La emisividad es simplemente un factor por el cual multiplicamos la transferencia de calor del cuerpo negro para tener en cuenta que el cuerpo negro es el caso ideal.
Por definición, un cuerpo negro en equilibrio térmico tiene una emisividad de ε =1,0. Los objetos reales no irradian tanto calor como un cuerpo negro perfecto. Irradian menos calor que un cuerpo negro y, por lo tanto, se denominan cuerpos grises. Para tener en cuenta el hecho de que los objetos reales son cuerpos grises, la ley de Stefan-Boltzmann debe incluir la emisividad. Cuantitativamente, la emisividad es la relación entre la radiación térmica de una superficie y la radiación de una superficie negra ideal a la misma temperatura dada por la ley de Stefan-Boltzmann. La emisividad es simplemente un factor por el cual multiplicamos la transferencia de calor del cuerpo negro para tener en cuenta que el cuerpo negro es el caso ideal.
La superficie de un cuerpo negro emite radiación térmica a una velocidad de aproximadamente 448 vatios por metro cuadrado a temperatura ambiente (25°C, 298,15 K). Los objetos reales con emisividades inferiores a 1,0 (por ejemplo, alambre de cobre) emiten radiación a tasas correspondientemente más bajas (por ejemplo, 448 x 0,03 = 13,4 W/m2). La emisividad juega un papel importante en los problemas de transferencia de calor. Por ejemplo, los colectores de calor solar incorporan superficies selectivas que tienen emisividades muy bajas. Estos colectores desperdician muy poca energía solar a través de la emisión de radiación térmica.
Otra propiedad de radiación importante de una superficie es su capacidad de absorción, α, que es la fracción de la energía de radiación incidente en una superficie que es absorbida por la superficie. Como la emisividad, el valor de la absortividad está en el rango 0 <α <1.
En general, la absortividad y la emisividad están interconectadas por la Ley de radiación térmica de Kirchhoff, que establece:
Para un cuerpo arbitrario que emite y absorbe radiación térmica en equilibrio termodinámico, la emisividad es igual a la absortividad.
emisividad ε = absortividad α
Tenga en cuenta que la radiación visible ocupa una banda muy estrecha del espectro de 0,4 a 0,76 nm, no podemos hacer ningún juicio sobre la negrura de una superficie sobre la base de observaciones visuales. Por ejemplo, considere el papel blanco que refleja la luz visible y, por lo tanto, parece blanco. Por otro lado, es esencialmente negro para la radiación infrarroja (absortividad α = 0,94) ya que absorben fuertemente la radiación de longitud de onda larga.
Ver también: manta térmica
Esperamos que este artículo, Propiedades térmicas de los materiales , le ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.