Un enlace químico es una atracción duradera entre estos átomos, iones o moléculas que permite la formación de compuestos químicos. El enlace puede resultar de la fuerza de atracción electrostática entre iones con carga opuesta, como en los enlaces iónicos, o mediante el intercambio de electrones, como en los enlaces covalentes. Por lo tanto, la fuerza electromagnética juega un papel importante en la determinación de las propiedades internas de la mayoría de los objetos que se encuentran en la vida diaria.
Enlace iónico
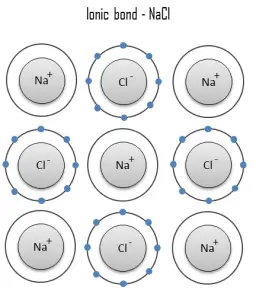 Un enlace iónico es un enlace químico, en el que uno o más electrones se transfieren por completo de un átomo de un elemento al átomo del otro, y los elementos se mantienen unidos por la fuerza de atracción debida a la polaridad opuesta de la carga. Este tipo de enlace químico es típico entre elementos con una gran diferencia de electronegatividad (es decir, elementos situados en los extremos horizontales de la tabla periódica ). Un enlace iónico siempre se encuentra en compuestos compuestos por elementos metálicos y no metálicos. No existe un valor preciso que distinga los enlaces iónicos de los covalentes, pero es probable que una diferencia de electronegatividad de más de 1,7 sea iónica, mientras que una diferencia de menos de 1,7 sea covalente.
Un enlace iónico es un enlace químico, en el que uno o más electrones se transfieren por completo de un átomo de un elemento al átomo del otro, y los elementos se mantienen unidos por la fuerza de atracción debida a la polaridad opuesta de la carga. Este tipo de enlace químico es típico entre elementos con una gran diferencia de electronegatividad (es decir, elementos situados en los extremos horizontales de la tabla periódica ). Un enlace iónico siempre se encuentra en compuestos compuestos por elementos metálicos y no metálicos. No existe un valor preciso que distinga los enlaces iónicos de los covalentes, pero es probable que una diferencia de electronegatividad de más de 1,7 sea iónica, mientras que una diferencia de menos de 1,7 sea covalente.
La unión iónica conduce a la separación de iones positivos y negativos. En el proceso, todos los átomos adquieren configuraciones de gas estable o inerte (es decir, capas orbitales completamente llenas) y, además, una carga eléctrica, es decir, se convierten en iones. Por ejemplo, la sal de mesa común es el cloruro de sodio. El cloruro de sodio (NaCl) es el material iónico clásico. Un átomo de sodio puede asumir la estructura electrónica del neón mediante la transferencia de su único electrón de valencia 3s a un átomo de cloro. Después de tal transferencia, el ion cloro adquiere una carga neta negativa, una configuración electrónica idéntica a la del argón; también es más grande que el átomo de cloro. Estos iones luego se atraen entre sí en una proporción de 1: 1 para formar cloruro de sodio (NaCl).
Na + Cl → Na + + Cl - → NaCl
Los compuestos iónicos conducen la electricidad cuando están fundidos o en solución, generalmente como un sólido. Los compuestos iónicos generalmente tienen un alto punto de fusión , dependiendo de la carga de los iones que los componen. Cuanto mayores sean las cargas, más fuertes serán las fuerzas cohesivas y mayor será el punto de fusión. También tienden a ser solubles en agua; cuanto más fuertes sean las fuerzas cohesivas, menor será la solubilidad.
[/ lgc_column]
Ciencia de los materiales:
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 1 y 2. Enero de 1993.
- Departamento de Energía de EE. UU., Ciencia de Materiales. DOE Fundamentals Handbook, Volumen 2 y 2. Enero de 1993.
- William D. Callister, David G. Rethwisch. Ciencia e Ingeniería de Materiales: Introducción 9ª Edición, Wiley; 9a edición (4 de diciembre de 2013), ISBN-13: 978-1118324578.
- Eberhart, Mark (2003). Por qué se rompen las cosas: comprender el mundo a través de la forma en que se desmorona. Armonía. ISBN 978-1-4000-4760-4.
- Gaskell, David R. (1995). Introducción a la Termodinámica de Materiales (4ª ed.). Taylor y Francis Publishing. ISBN 978-1-56032-992-3.
- González-Viñas, W. y Mancini, HL (2004). Introducción a la ciencia de los materiales. Prensa de la Universidad de Princeton. ISBN 978-0-691-07097-1.
- Ashby, Michael; Hugh Shercliff; David Cebon (2007). Materiales: ingeniería, ciencia, procesamiento y diseño (1ª ed.). Butterworth-Heinemann. ISBN 978-0-7506-8391-3.
- JR Lamarsh, AJ Baratta, Introducción a la ingeniería nuclear, 3d ed., Prentice-Hall, 2001, ISBN: 0-201-82498-1.
[/ su_spoiler] [/ su_accordion]
[/ lgc_column]Véase más arriba:
Enlace químico [/ su_button] [/ lgc_column]
Esperamos que este artículo, Ionic Bond , te ayude. Si es así, danos un me gusta en la barra lateral. El objetivo principal de este sitio web es ayudar al público a conocer información importante e interesante sobre los materiales y sus propiedades.