Este artículo contiene una comparación de las propiedades térmicas y atómicas clave del sodio y el azufre, dos elementos químicos comparables de la tabla periódica. También contiene descripciones básicas y aplicaciones de ambos elementos. Sodio vs Azufre.
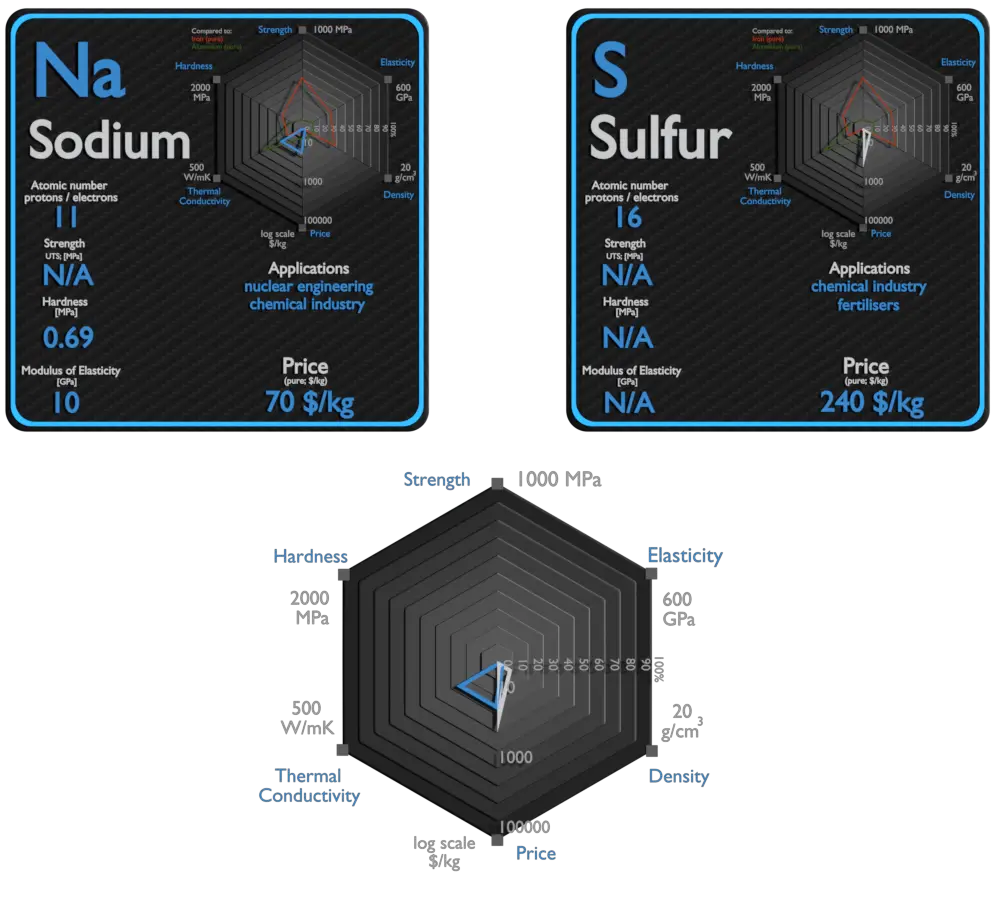
Sodio y Azufre: acerca de los elementos


Fuente: www.luciteria.com
Sodio y Azufre – Aplicaciones
Sodio
El sodio metálico se utiliza principalmente para la producción de borohidruro de sodio, azida de sodio, índigo y trifenilfosfina. Un uso que alguna vez fue común fue la fabricación de plomo tetraetílico y metal de titanio; debido al alejamiento de TEL y los nuevos métodos de producción de titanio. Una corriente eléctrica y un vapor de sodio se combinan para formar un resplandor amarillento. Este principio se utiliza para la fabricación de lámparas de vapor de sodio. El sodio se utiliza ocasionalmente como medio de intercambio de calor en centrales nucleares. El sodio líquido se sella en las tuberías que rodean el núcleo del reactor. El calor generado es absorbido por el sodio y forzado a través de las tuberías en un intercambiador de calor que se puede utilizar para generar electricidad.
Azufre
El mayor uso comercial del elemento es la producción de ácido sulfúrico para fertilizantes de sulfato y fosfato y otros procesos químicos. El azufre se utiliza cada vez más como componente de fertilizantes. La forma más importante de azufre para fertilizantes es el mineral sulfato de calcio. El elemento azufre se utiliza en fósforos, insecticidas y fungicidas. Muchos compuestos de azufre son olorosos, y los olores del gas natural aromatizado, el aroma de la mofeta, la toronja y el ajo se deben a compuestos orgánicos de azufre.
Sodio y Azufre: comparación en la tabla
| Elemento | Sodio | Azufre |
| Densidad | 0,968 g / cm3 | 1,96 g / cm3 |
| Resistencia a la tracción | N / A | N / A |
| Límite de elastacidad | N / A | N / A |
| Módulo de Young | 10 GPa | N / A |
| Escala de Mohs | 0,4 | 2 |
| Dureza Brinell | 0,69 MPa | N / A |
| Dureza Vickers | N / A | N / A |
| Punto de fusion | 97,8 ° C | 112,8 ° C |
| Punto de ebullición | 883 ° C | 444,7 ° C |
| Conductividad térmica | 141 W / mK | 0,269 W / mK |
| Coeficiente de expansión térmica | 71 µm / mK | N / A |
| Calor especifico | 1,23 J / g K | 0,71 J / g K |
| Calor de fusión | 2,598 kJ / mol | 1,7175 kJ / mol |
| Calor de vaporización | 96,96 kJ / mol | 45 kJ / mol |









