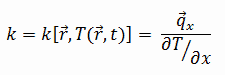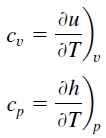Sobre o Dióxido de Carbono
O dióxido de carbono é um gás incolor com uma densidade cerca de 53% maior que a do ar seco. É relativamente não tóxico e não combustível, mas é mais pesado que o ar e pode asfixiar pelo deslocamento do ar. Quando o CO2 é dissolvido em água, o ácido carbônico suave é formado. O CO2 resfriado na forma sólida é chamado de gelo seco. O dióxido de carbono é um componente menor da atmosfera da Terra, mas constituinte importante do ar. É uma matéria-prima necessária para a maioria das plantas, que removem o dióxido de carbono do ar usando o processo de fotossíntese. Uma concentração típica de CO2 no ar é atualmente cerca de 0,040% ou 404 ppm. A concentração de dióxido de carbono atmosférico aumenta e diminui em um padrão sazonal em uma faixa de cerca de 6 ppmv. A concentração de CO2 no ar também vem aumentando de ano para ano há mais de 70 anos. A taxa atual de aumento é de cerca de 2,5 ppm por ano.

Resumo
| Nome | Dióxido de Carbono |
| Fase em STP | gasoso |
| Densidade | 2 kg/m3 |
| Resistência à tração | N/D |
| Força de rendimento | N/D |
| Módulo de elasticidade de Young | N/D |
| Dureza Brinell | N/D |
| Ponto de fusão | -57 °C |
| Condutividade térmica | 0,0166 W/mK |
| Capacidade de calor | 840 J/gK |
| Preço | 2 $/kg |
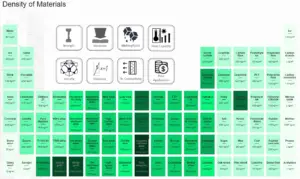
Densidade do Dióxido de Carbono
As densidades típicas de várias substâncias estão à pressão atmosférica. A densidade é definida como a massa por unidade de volume. É uma propriedade intensiva, que é matematicamente definida como massa dividida pelo volume: ρ = m/V.
Em palavras, a densidade (ρ) de uma substância é a massa total (m) dessa substância dividida pelo volume total (V) ocupado por essa substância. A unidade padrão do SI é quilogramas por metro cúbico (kg/m3). A unidade padrão inglesa é libras de massa por pé cúbico (lbm/ft3).
A densidade do Dióxido de Carbono é de 2 kg/m3.
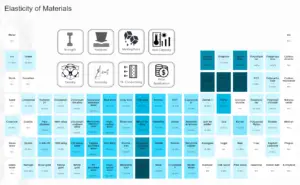
Densidade de Materiais
Propriedades Térmicas do Dióxido de Carbono
Dióxido de Carbono – Ponto de Fusão
O ponto de fusão do Dióxido de Carbono é -57 °C.
Observe que esses pontos estão associados à pressão atmosférica padrão. Em geral, a fusão é uma mudança de fase de uma substância da fase sólida para a líquida. O ponto de fusão de uma substância é a temperatura na qual essa mudança de fase ocorre. O ponto de fusão também define uma condição na qual o sólido e o líquido podem existir em equilíbrio. Para vários compostos químicos e ligas, é difícil definir o ponto de fusão, pois geralmente são uma mistura de vários elementos químicos.
Dióxido de Carbono – Condutividade Térmica
A condutividade térmica do Dióxido de Carbono é 0,0166 W/(m·K).
As características de transferência de calor de um material sólido são medidas por uma propriedade chamada condutividade térmica, k (ou λ), medida em W/mK. É uma medida da capacidade de uma substância de transferir calor através de um material por condução. Observe que a lei de Fourier se aplica a toda matéria, independentemente de seu estado (sólido, líquido ou gasoso), portanto, também é definida para líquidos e gases.
A condutividade térmica da maioria dos líquidos e sólidos varia com a temperatura. Para vapores, também depende da pressão. No geral:
A maioria dos materiais são quase homogêneos, portanto, geralmente podemos escrever k = k(T). Definições semelhantes estão associadas a condutividades térmicas nas direções y e z (ky, kz), mas para um material isotrópico a condutividade térmica é independente da direção de transferência, kx = ky = kz = k.
Dióxido de Carbono – Calor Específico
O calor específico do Dióxido de Carbono é 840 J/g K.
Calor específico, ou capacidade calorífica específica, é uma propriedade relacionada à energia interna que é muito importante na termodinâmica. As propriedades intensivas cv e cp são definidas para substâncias compressíveis puras simples como derivadas parciais da energia interna u(T, v) e entalpia h(T, p), respectivamente:
onde os subscritos v e p denotam as variáveis mantidas fixas durante a diferenciação. As propriedades cv e cp são chamadas de calores específicos (ou capacidades térmicas) porque, sob certas condições especiais, elas relacionam a mudança de temperatura de um sistema com a quantidade de energia adicionada pela transferência de calor. Suas unidades no SI são J/kg K ou J/mol K.