Este artigo contém uma comparação das principais propriedades térmicas e atômicas do tório e do urânio, dois elementos químicos comparáveis da tabela periódica. Ele também contém descrições básicas e aplicações de ambos os elementos. Tório vs. Urânio.

Tório e Urânio – Sobre os Elementos


Fonte: www.luciteria.com
Tório e Urânio – Aplicações
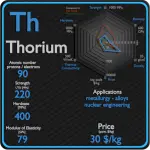
Tório
A maioria das aplicações de tório usa seu dióxido (às vezes chamado de “thoria” na indústria), em vez do metal. Este composto tem um ponto de fusão de 3300 °C (6000 °F), o mais alto de todos os óxidos conhecidos; apenas algumas substâncias têm pontos de fusão mais altos.[46] Isso ajuda o composto a permanecer sólido na chama e aumenta consideravelmente o brilho da chama; esta é a principal razão pela qual o tório é usado em mantas de lâmpadas a gás. Todas as substâncias emitem energia (brilho) em altas temperaturas, mas a luz emitida pelo tório está quase toda no espectro visível, daí o brilho dos mantos de tório. O tório é um importante agente de liga no magnésio, pois confere maior resistência e resistência à fluência em altas temperaturas. O óxido de tório é usado como um catalisador industrial. Outros usos para o tório incluem cerâmica resistente ao calor, motores de aeronaves e lâmpadas. O tório pode ser usado como fonte de energia nuclear. É cerca de três vezes mais abundante que o urânio e tão abundante quanto o chumbo, e provavelmente há mais energia disponível do tório do que do urânio e dos combustíveis fósseis. 232Th é um isótopo fértil. 232Th não é capaz de sofrer reação de fissão após absorver nêutrons térmicos, por outro lado 232Th pode ser fissionado por nêutrons rápidos com energia superior a >1MeV. A Índia e a China estão desenvolvendo usinas nucleares com reatores de tório, mas essa ainda é uma tecnologia muito nova. Anteriormente, o dióxido de tório era adicionado ao vidro durante a fabricação para aumentar o índice de refração, produzindo vidro toriado para uso em lentes de câmera de alta qualidade. e provavelmente há mais energia disponível do tório do que do urânio e dos combustíveis fósseis. 232Th é um isótopo fértil. 232Th não é capaz de sofrer reação de fissão após absorver nêutrons térmicos, por outro lado 232Th pode ser fissionado por nêutrons rápidos com energia superior a >1MeV. A Índia e a China estão desenvolvendo usinas nucleares com reatores de tório, mas essa ainda é uma tecnologia muito nova. Anteriormente, o dióxido de tório era adicionado ao vidro durante a fabricação para aumentar o índice de refração, produzindo vidro toriado para uso em lentes de câmera de alta qualidade. e provavelmente há mais energia disponível do tório do que do urânio e dos combustíveis fósseis. 232Th é um isótopo fértil. 232Th não é capaz de sofrer reação de fissão após absorver nêutrons térmicos, por outro lado 232Th pode ser fissionado por nêutrons rápidos com energia superior a >1MeV. A Índia e a China estão desenvolvendo usinas nucleares com reatores de tório, mas essa ainda é uma tecnologia muito nova. Anteriormente, o dióxido de tório era adicionado ao vidro durante a fabricação para aumentar o índice de refração, produzindo vidro toriado para uso em lentes de câmera de alta qualidade. por outro lado, o 232Th pode ser fissionado por nêutrons rápidos com energia superior a >1MeV. A Índia e a China estão desenvolvendo usinas nucleares com reatores de tório, mas essa ainda é uma tecnologia muito nova. Anteriormente, o dióxido de tório era adicionado ao vidro durante a fabricação para aumentar o índice de refração, produzindo vidro toriado para uso em lentes de câmera de alta qualidade. por outro lado, o 232Th pode ser fissionado por nêutrons rápidos com energia superior a >1MeV. A Índia e a China estão desenvolvendo usinas nucleares com reatores de tório, mas essa ainda é uma tecnologia muito nova. Anteriormente, o dióxido de tório era adicionado ao vidro durante a fabricação para aumentar o índice de refração, produzindo vidro toriado para uso em lentes de câmera de alta qualidade.
Urânio
O principal uso de urânio no setor civil é para abastecer usinas nucleares. Um quilograma de urânio-235 pode teoricamente produzir cerca de 20 terajoules de energia, assumindo fissão completa; tanta energia quanto 1,5 milhão de quilogramas (1500 toneladas) de carvão. O reator típico pode conter cerca de 100 toneladas de urânio enriquecido (ou seja, cerca de 113 toneladas de dióxido de urânio). Este combustível é carregado, por exemplo, em 157 conjuntos de combustível compostos por mais de 45000 barras de combustível. Um conjunto de combustível comum contém energia para aproximadamente 4 anos de operação em potência máxima. O combustível removido (combustível nuclear gasto) ainda contém cerca de 96% de material reutilizável (deve ser removido devido à diminuição do kinf de um conjunto). Antes (e, ocasionalmente, depois) da descoberta da radioatividade, o urânio era usado principalmente em pequenas quantidades para vidro amarelo e esmaltes de cerâmica, como vidro de urânio. O urânio também é usado pelos militares para alimentar submarinos nucleares e em armas nucleares. Devido à sua alta densidade, este material é encontrado em sistemas de orientação inercial e em bússolas giroscópicas.[10] O urânio empobrecido é preferido em relação aos metais igualmente densos devido à sua capacidade de ser facilmente usinado e fundido, bem como seu custo relativamente baixo. O principal risco de exposição ao urânio empobrecido é o envenenamento químico por óxido de urânio, em vez de radioatividade (o urânio é apenas um emissor alfa fraco). O urânio empobrecido é o urânio que tem muito menos urânio-235 do que o urânio natural. É consideravelmente menos radioativo que o urânio natural. É um metal denso que pode ser usado como lastro para navios e contrapesos para aeronaves. Também é usado em munições e armaduras. O urânio empobrecido também pode ser usado para proteger a radiação. O urânio empobrecido é muito mais eficaz devido ao seu Z mais alto. O urânio empobrecido é usado para blindagem em fontes portáteis de raios gama. O urânio é usado em aços rápidos como agente de liga para melhorar a resistência e a tenacidade. O trióxido de urânio (também chamado de óxido urânico) com fórmula UO3, é um pó amarelo alaranjado e é usado como pigmento para cerâmica. Em copos produz um belo “vidro de urânio” amarelo-esverdeado.
Tório e Urânio – Comparação na Tabela
| Elemento | Tório | Urânio |
| Densidade | 11,724 g/cm3 | 19,05 g/cm3 |
| Resistência à tração | 220 MPa | 390 MPa |
| Força de rendimento | 144 MPa | 190 MPa |
| Módulo de elasticidade de Young | 79 GPa | 208 GPa |
| Escala de Mohs | 3 | 6 |
| Dureza Brinell | 400 MPa | 2400 MPa |
| Dureza Vickers | 350 MPa | 1960 MPa |
| Ponto de fusão | 1750 °C | 1132 °C |
| Ponto de ebulição | 4790 °C | 4131 °C |
| Condutividade térmica | 54 W/mK | 27 W/mK |
| Coeficiente de Expansão Térmica | 11 µm/mK | 13,9 µm/mK |
| Calor específico | 0,12 J/gK | 0,12 J/gK |
| Calor de fusão | 13,8 kJ/mol | 8,52 kJ/mol |
| Calor da vaporização | 514,4 kJ/mol | 417 kJ/mol |