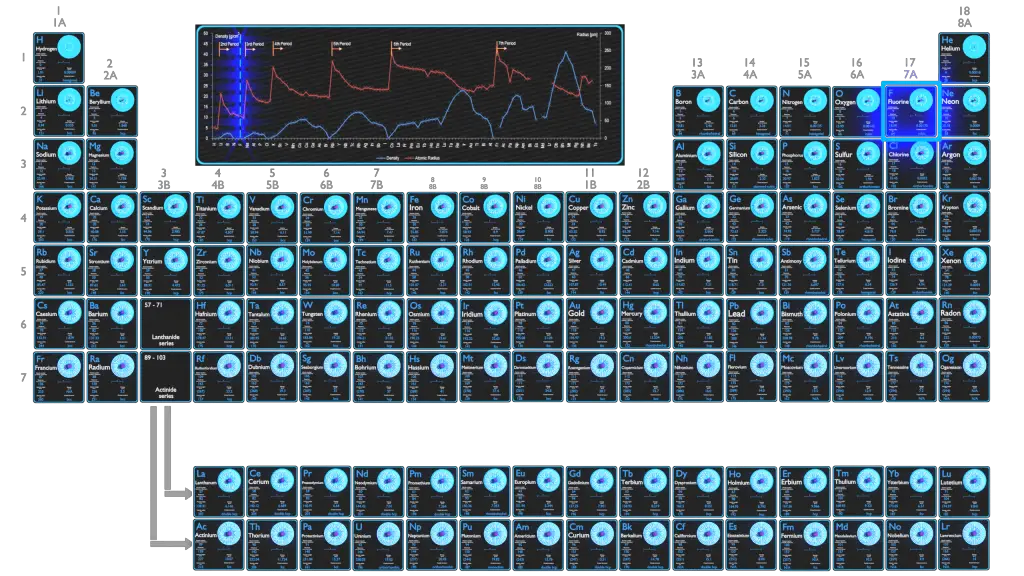
El flúor es el halógeno más ligero y existe como un gas diatómico amarillo pálido altamente tóxico en condiciones estándar. Como elemento más electronegativo, es extremadamente reactivo: casi todos los demás elementos, incluidos algunos gases nobles, forman compuestos con flúor.
Resumen
| Elemento | Flúor |
| Número atómico | 9 |
| Masa atómica [amu] | 18,9984 |
| Masa atómica [pm] | 64 |
| Densidad en STP [g / cm3] | 0,00170 |
| Numero de protones | 9 |
| Número de neutrones (isótopos típicos) | 19 |
| Numero de electrones | 9 |
| Configuración electronica | [Él] 2s2 2p5 |
| Estados de oxidación | -1 |
| Afinidad electrónica [kJ / mol] | 328 |
| Electronegatividad [escala de Pauling] | 3,98 |
| Primera energía de ionización [eV] | 17,4228 |
Número atómico: protones, electrones y neutrones en Flúor
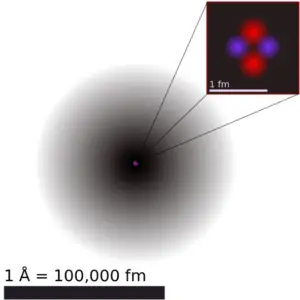
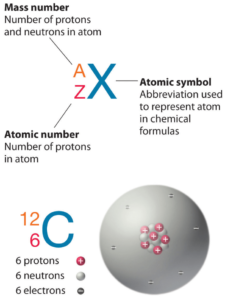 El flúor es un elemento químico con número atómico 9, lo que significa que hay 9 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El flúor es un elemento químico con número atómico 9, lo que significa que hay 9 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El número total de neutrones en el núcleo de un átomo se llama el número de neutrones del átomo y se le da el símbolo N . Número de neutrones más el número atómico es igual al número de masa atómica: N + Z = A . La diferencia entre el número de neutrones y el número atómico se conoce como exceso de neutrones : D = N – Z = A – 2Z.
Para los elementos estables, suele haber una variedad de isótopos estables. Los isótopos son nucleidos que tienen el mismo número atómico y, por lo tanto, son el mismo elemento, pero difieren en el número de neutrones. Los números de masa de isótopos típicos de flúor son 19.
Masa atómica de Flúor
La masa atómica del flúor es 18,9984 u.
La masa atómica es la masa de un átomo. La masa atómica o masa isotópica relativa se refiere a la masa de una sola partícula y, por lo tanto, está ligada a un determinado isótopo específico de un elemento. La masa atómica es transportada por el núcleo atómico, que ocupa sólo alrededor de 10-12 del volumen total del átomo o menos, pero contiene toda la carga positiva y al menos el 99,95% de la masa total del átomo. Tenga en cuenta que, cada elemento puede contener más isótopos , por lo tanto, esta masa atómica resultante se calcula a partir de los isótopos naturales y su abundancia.
Radio atómico del Flúor
El radio atómico del átomo de flúor es 64 pm (radio covalente).
Cabe señalar que los átomos carecen de un límite exterior bien definido. El radio atómico de un elemento químico es una medida de la distancia a la que se extiende la nube de electrones desde el núcleo. Sin embargo, esto supone que el átomo exhibe una forma esférica, que solo se obedece a los átomos en el vacío o en el espacio libre. Por lo tanto, existen varias definiciones no equivalentes de radio atómico.
Electrones y configuración electrónica
El número de electrones en un átomo eléctricamente neutro es el mismo que el número de protones en el núcleo. Por lo tanto, el número de electrones en el átomo neutro de flúor es 9. Cada electrón está influenciado por los campos eléctricos producidos por la carga nuclear positiva y los otros electrones negativos (Z – 1) en el átomo.
La configuración electrónica del flúor es [He] 2s2 2p5 .
Los posibles estados de oxidación son -1 .
Densidad de Flúor
La densidad del flúor es 0,00170 g / cm 3 .
Las densidades típicas de varias sustancias se encuentran a presión atmosférica.
La densidad se define como la masa por unidad de volumen . Es una propiedad intensiva , que se define matemáticamente como masa dividida por volumen:
ρ = m / V
Afinidad electrónica: Flúor
La afinidad electrónica del flúor es 328 kJ / mol .
En química y física atómica, la afinidad electrónica de un átomo o molécula se define como:
el cambio de energía (en kJ / mol) de un átomo o molécula neutro (en la fase gaseosa) cuando se agrega un electrón al átomo para formar un ion negativo .
X + e – → X – + energía Afinidad = – ∆H
En otras palabras, se puede expresar como la probabilidad del átomo neutro de ganar un electrón . Tenga en cuenta que las energías de ionización miden la tendencia de un átomo neutro a resistir la pérdida de electrones. Las afinidades electrónicas son más difíciles de medir que las energías de ionización.
Electronegatividad del Flúor
La electronegatividad del flúor es 3,98 .
La electronegatividad , símbolo χ, es una propiedad química que describe la tendencia de un átomo a atraer electrones hacia este átomo. A estos efectos, una cantidad adimensional, la escala de Pauling , símbolo χ, es la más utilizada.
La electronegatividad del flúor es: χ = 3,98
Primera energía de ionización del Flúor
La primera energía de ionización del flúor es 17,4228 eV .
La energía de ionización , también llamada potencial de ionización , es la energía necesaria para eliminar un electrón del átomo neutro.
X + energía → X + + e –
donde X es cualquier átomo o molécula capaz de ionizarse, X + es ese átomo o molécula con un electrón eliminado (ion positivo) y e – es el electrón eliminado.
Un átomo de flúor, por ejemplo, requiere la siguiente energía de ionización para eliminar el electrón más externo.
F + IE → F + + e – IE = 17,4228 eV
Fuente: www.luciteria.com