El antimonio es un metaloide gris brillante, se encuentra en la naturaleza principalmente como estibina mineral de sulfuro. Los compuestos de antimonio se conocen desde la antigüedad y se pulverizaban para su uso como medicina y cosmética, a menudo conocidos con el nombre árabe de kohl.
Resumen
| Elemento | Antimonio |
| Número atómico | 51 |
| Masa atómica [amu] | 121,76 |
| Masa atómica [pm] | 139 |
| Densidad en STP [g / cm3] | 6,697 |
| Numero de protones | 51 |
| Número de neutrones (isótopos típicos) | 121, 123 |
| Numero de electrones | 51 |
| Configuración electronica | [Kr] 4d10 5s2 5p3 |
| Estados de oxidación | + 3,5 / -3 |
| Afinidad electrónica [kJ / mol] | 103,2 |
| Electronegatividad [escala de Pauling] | 2,05 |
| Primera energía de ionización [eV] | 8,64 |
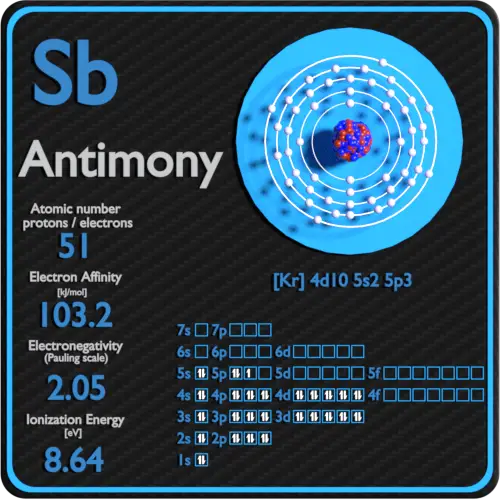
Número atómico: protones, electrones y neutrones en el Antimonio
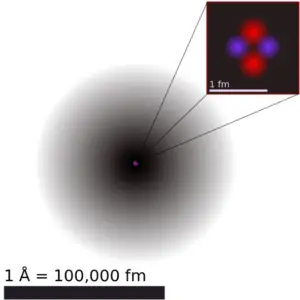
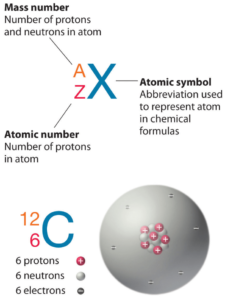 El antimonio es un elemento químico con número atómico 51, lo que significa que hay 51 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El antimonio es un elemento químico con número atómico 51, lo que significa que hay 51 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El número total de neutrones en el núcleo de un átomo se llama el número de neutrones del átomo y se le da el símbolo N . Número de neutrones más el número atómico es igual al número de masa atómica: N + Z = A . La diferencia entre el número de neutrones y el número atómico se conoce como exceso de neutrones : D = N – Z = A – 2Z.
Para los elementos estables, suele haber una variedad de isótopos estables. Los isótopos son nucleidos que tienen el mismo número atómico y, por lo tanto, son el mismo elemento, pero difieren en el número de neutrones. Los números masivos de isótopos típicos de antimonio son 121, 123.
Masa atómica de Antimonio
La masa atómica del antimonio es 121,76 u.
La masa atómica es la masa de un átomo. La masa atómica o masa isotópica relativa se refiere a la masa de una sola partícula y, por lo tanto, está ligada a un determinado isótopo específico de un elemento. La masa atómica es transportada por el núcleo atómico, que ocupa sólo alrededor de 10-12 del volumen total del átomo o menos, pero contiene toda la carga positiva y al menos el 99,95% de la masa total del átomo. Tenga en cuenta que, cada elemento puede contener más isótopos , por lo tanto, esta masa atómica resultante se calcula a partir de los isótopos naturales y su abundancia.
Radio atómico de Antimonio
El radio atómico del átomo de antimonio es 139 pm (radio covalente).
Cabe señalar que los átomos carecen de un límite exterior bien definido. El radio atómico de un elemento químico es una medida de la distancia a la que se extiende la nube de electrones desde el núcleo. Sin embargo, esto supone que el átomo exhibe una forma esférica, que solo se obedece a los átomos en el vacío o en el espacio libre. Por lo tanto, existen varias definiciones no equivalentes de radio atómico.
Electrones y configuración electrónica
El número de electrones en un átomo eléctricamente neutro es el mismo que el número de protones en el núcleo. Por lo tanto, el número de electrones en el átomo neutro de Antimonio es 51. Cada electrón está influenciado por los campos eléctricos producidos por la carga nuclear positiva y los otros electrones negativos (Z – 1) en el átomo.
La configuración electrónica del antimonio es [Kr] 4d10 5s2 5p3 .
Los posibles estados de oxidación son + 3,5 / -3 .
Densidad del Antimonio
La densidad del antimonio es de 6,697 g / cm 3 .
Las densidades típicas de varias sustancias se encuentran a presión atmosférica.
La densidad se define como la masa por unidad de volumen . Es una propiedad intensiva , que se define matemáticamente como masa dividida por volumen:
ρ = m / V
Afinidad electrónica – Antimonio
La afinidad electrónica del antimonio es 103,2 kJ / mol .
En química y física atómica, la afinidad electrónica de un átomo o molécula se define como:
el cambio de energía (en kJ / mol) de un átomo o molécula neutro (en la fase gaseosa) cuando se agrega un electrón al átomo para formar un ion negativo .
X + e – → X – + energía Afinidad = – ∆H
En otras palabras, se puede expresar como la probabilidad del átomo neutro de ganar un electrón . Tenga en cuenta que las energías de ionización miden la tendencia de un átomo neutro a resistir la pérdida de electrones. Las afinidades electrónicas son más difíciles de medir que las energías de ionización.
Electronegatividad del Antimonio
La electronegatividad del antimonio es 2,05 .
La electronegatividad , símbolo χ, es una propiedad química que describe la tendencia de un átomo a atraer electrones hacia este átomo. Para este propósito, una cantidad adimensional, la escala de Pauling , símbolo χ, es la más utilizada.
La electronegatividad del antimonio es: χ = 2,05
Primera energía de ionización del Antimonio
La primera energía de ionización del antimonio es de 8,64 eV .
La energía de ionización , también llamada potencial de ionización , es la energía necesaria para eliminar un electrón del átomo neutro.
X + energía → X + + e –
donde X es cualquier átomo o molécula capaz de ionizarse, X + es ese átomo o molécula con un electrón eliminado (ion positivo) y e – es el electrón eliminado.
Un átomo de antimonio, por ejemplo, requiere la siguiente energía de ionización para eliminar el electrón más externo.
Sb + IE → Sb + + e – IE = 8,64 eV
Fuente: www.luciteria.com