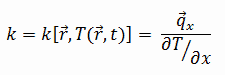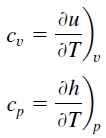Acerca del dióxido de carbono
El dióxido de carbono es un gas incoloro con una densidad aproximadamente un 53% más alta que la del aire seco. Es relativamente no tóxico y no combustible, pero es más pesado que el aire y puede asfixiarse por el desplazamiento del aire. Cuando el CO2 se disuelve en agua, se forma el ácido carbónico suave. El CO2 enfriado en forma sólida se llama hielo seco. El dióxido de carbono es un componente menor de la atmósfera terrestre, pero un componente importante del aire. Es una materia prima necesaria para la mayoría de las plantas, que eliminan el dióxido de carbono del aire mediante el proceso de fotosíntesis. Una concentración típica de CO2 en el aire es actualmente de aproximadamente 0,040% o 404 ppm. La concentración de dióxido de carbono atmosférico aumenta y disminuye en un patrón estacional en un rango de aproximadamente 6 ppmv. La concentración de CO2 en el aire también ha aumentado constantemente de año durante más de 70 años. La tasa actual de aumento es de aproximadamente 2,5 ppm por año.

Resumen
| Nombre | Dióxido de carbono |
| Fase en STP | gaseoso |
| Densidad | 2 kg / m3 |
| Resistencia a la tracción | N / A |
| Límite de elastacidad | N / A |
| Módulo de Young | N / A |
| Dureza Brinell | N / A |
| Punto de fusión | -57 ° C |
| Conductividad térmica | 0,0166 W / mK |
| Capacidad calorífica | 840 J / g K |
| Precio | 2 $ / kg |
Composición de dióxido de carbono
Las moléculas de dióxido de carbono consiste en un átomo de carbono con doble enlace covalente a dos átomos de oxígeno.
Aplicaciones del dióxido de carbono

El dióxido de carbono es utilizado por la industria alimentaria, la industria petrolera y la industria química. El compuesto tiene usos comerciales variados, pero uno de sus mayores usos como químico es en la producción de bebidas carbonatadas; proporciona el brillo en las bebidas carbonatadas como el agua de soda, la cerveza y el vino espumoso. El dióxido de carbono también se utiliza como refrigerante, en extintores, para inflar balsas salvavidas y chalecos salvavidas, para detonar carbón, espuma de goma y plásticos, promoviendo el crecimiento de plantas en invernaderos. El dióxido de carbono también se utiliza como atmósfera para soldar, aunque en el arco de soldadura reacciona para oxidar la mayoría de los metales.
Propiedades térmicas del dióxido de carbono
Dióxido de carbono – Punto de fusión
Punto de Dióxido de Carbono de fusión es de -57 ° C .
Tenga en cuenta que estos puntos están asociados con la presión atmosférica estándar. En general, la fusión es un cambio de fase de una sustancia de la fase sólida a la líquida. El punto de fusión de una sustancia es la temperatura a la que se produce este cambio de fase. El punto de fusión también define una condición en la que el sólido y el líquido pueden existir en equilibrio. Para varios compuestos químicos y aleaciones, es difícil definir el punto de fusión, ya que generalmente son una mezcla de varios elementos químicos.
Dióxido de carbono: conductividad térmica
La conductividad térmica del dióxido de carbono es 0,0166 W / (m · K) .
Las características de transferencia de calor de un material sólido se miden mediante una propiedad llamada conductividad térmica , k (o λ), medida en W / mK . Es una medida de la capacidad de una sustancia para transferir calor a través de un material por conducción . Tenga en cuenta que la ley de Fourier se aplica a toda la materia, independientemente de su estado (sólido, líquido o gas), por lo que también se define para líquidos y gases.
La conductividad térmica de la mayoría de los líquidos y variadas con la temperatura. Para los vapores, también depende de la presión. En general:
La mayoría de los materiales son casi homogéneos, por lo que normalmente podemos escribir k = k (T) . Se asocian definiciones similares con las conductividades térmicas en las direcciones yyz (ky, kz), pero para un material isótropo, la conductividad térmica es independiente de la dirección de transferencia, kx = ky = kz = k.
Dióxido de carbono – Calor específico
El calor Específico de Dióxido de Carbono es de 840 J / g K .
El calor específico, o capacidad calorífica específica, es una propiedad relacionada con la energía interna que es muy importante en termodinámica. Las propiedades intensivas c v y c p se definen para sustancias compresibles simples puras como derivadas parciales de la energía interna u (T, v) y la entalpía h (T, p) , respectivamente:
donde los subíndices v y p denotan las variables que se mantienen fijas durante la diferenciación. Las propiedades c v y c p se denominan calores específicas (o capacidades caloríficas ), en determinadas condiciones especiales, relacionan el cambio de temperatura de un sistema con la cantidad de energía añadida por la transferencia de calor. Unidades Sus SI hijo J / kg K o J / K mol .
Propiedades y precios de otros materiales
tabla-de-materiales-en-resolución-8k