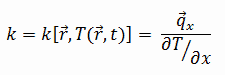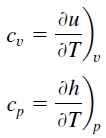Sobre o Dióxido de Carbono
O dióxido de carbono é um gás incolor com uma densidade cerca de 53% maior que a do ar seco. É relativamente não tóxico e não combustível, mas é mais pesado que o ar e pode asfixiar pelo deslocamento do ar. Quando o CO2 é dissolvido em água, o ácido carbônico suave é formado. O CO2 resfriado na forma sólida é chamado de gelo seco. O dióxido de carbono é um componente menor da atmosfera da Terra, mas constituinte importante do ar. É uma matéria-prima necessária para a maioria das plantas, que removem o dióxido de carbono do ar usando o processo de fotossíntese. Uma concentração típica de CO2 no ar é atualmente cerca de 0,040% ou 404 ppm. A concentração de dióxido de carbono atmosférico aumenta e diminui em um padrão sazonal em uma faixa de cerca de 6 ppmv. A concentração de CO2 no ar também vem aumentando de ano para ano há mais de 70 anos. A taxa atual de aumento é de cerca de 2,5 ppm por ano.

Resumo
| Nome | Dióxido de Carbono |
| Fase em STP | gasoso |
| Densidade | 2 kg/m3 |
| Resistência à tração | N/D |
| Força de rendimento | N/D |
| Módulo de elasticidade de Young | N/D |
| Dureza Brinell | N/D |
| Ponto de fusão | -57 °C |
| Condutividade térmica | 0,0166 W/mK |
| Capacidade de calor | 840 J/gK |
| Preço | 2 $/kg |
Composição do Dióxido de Carbono
As moléculas de dióxido de carbono consistem em um átomo de carbono ligado covalentemente a dois átomos de oxigênio.
Aplicações do Dióxido de Carbono

O dióxido de carbono é usado pela indústria alimentícia, indústria petrolífera e indústria química. O composto tem usos comerciais variados, mas um de seus maiores usos como produto químico é na produção de bebidas carbonatadas; ele fornece o brilho em bebidas gaseificadas, como água com gás, cerveja e vinho espumante. O dióxido de carbono também é usado como refrigerante, em extintores de incêndio, para inflar botes salva-vidas e coletes salva-vidas, explodir carvão, espuma de borracha e plásticos, promovendo o crescimento de plantas em estufas. O dióxido de carbono também é usado como atmosfera para soldagem, embora no arco de soldagem reage para oxidar a maioria dos metais. O uso na indústria automotiva é comum, apesar das evidências significativas de que as soldas feitas em dióxido de carbono são mais frágeis do que aquelas feitas em atmosferas mais inertes.
Propriedades Térmicas do Dióxido de Carbono
Dióxido de Carbono – Ponto de Fusão
O ponto de fusão do Dióxido de Carbono é -57 °C.
Observe que esses pontos estão associados à pressão atmosférica padrão. Em geral, a fusão é uma mudança de fase de uma substância da fase sólida para a líquida. O ponto de fusão de uma substância é a temperatura na qual essa mudança de fase ocorre. O ponto de fusão também define uma condição na qual o sólido e o líquido podem existir em equilíbrio. Para vários compostos químicos e ligas, é difícil definir o ponto de fusão, pois geralmente são uma mistura de vários elementos químicos.
Dióxido de Carbono – Condutividade Térmica
A condutividade térmica do Dióxido de Carbono é 0,0166 W/(m·K).
As características de transferência de calor de um material sólido são medidas por uma propriedade chamada condutividade térmica, k (ou λ), medida em W/mK. É uma medida da capacidade de uma substância de transferir calor através de um material por condução. Observe que a lei de Fourier se aplica a toda matéria, independentemente de seu estado (sólido, líquido ou gasoso), portanto, também é definida para líquidos e gases.
A condutividade térmica da maioria dos líquidos e sólidos varia com a temperatura. Para vapores, também depende da pressão. No geral:
A maioria dos materiais são quase homogêneos, portanto, geralmente podemos escrever k = k(T). Definições semelhantes estão associadas a condutividades térmicas nas direções y e z (ky, kz), mas para um material isotrópico a condutividade térmica é independente da direção de transferência, kx = ky = kz = k.
Dióxido de Carbono – Calor Específico
O calor específico do Dióxido de Carbono é 840 J/gK.
Calor específico, ou capacidade calorífica específica, é uma propriedade relacionada à energia interna que é muito importante na termodinâmica. As propriedades intensivas cv e cp são definidas para substâncias compressíveis puras simples como derivadas parciais da energia interna u(T, v) e entalpia h(T, p), respectivamente:
onde os subscritos v e p denotam as variáveis mantidas fixas durante a diferenciação. As propriedades cv e cp são chamadas de calores específicos (ou capacidades térmicas) porque, sob certas condições especiais, elas relacionam a mudança de temperatura de um sistema com a quantidade de energia adicionada pela transferência de calor. Suas unidades no SI são J/kg K ou J/mol K.
Propriedades e preços de outros materiais
tabela de materiais em resolução de 8k