Este artículo contiene una comparación de las propiedades térmicas y atómicas clave del potasio y el bromo, dos elementos químicos comparables de la tabla periódica. También contiene descripciones básicas y aplicaciones de ambos elementos. Potasio vs Bromo.
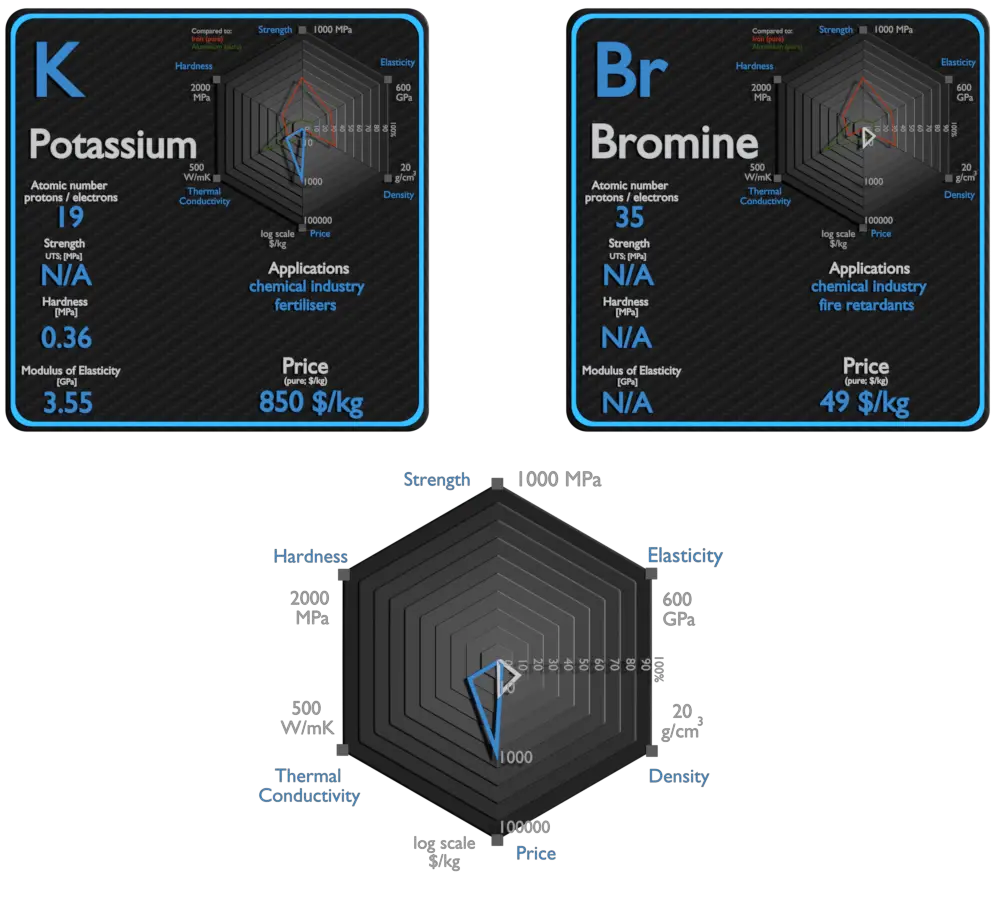
Potasio y Bromo: acerca de los elementos


Fuente: www.luciteria.com
Potasio y Bromo: aplicaciones
Potasio
El potasio (K) es un nutriente esencial para el crecimiento de las plantas. Se clasifica como un macronutriente porque las plantas absorben grandes cantidades de K durante su ciclo de vida. Los fertilizantes agrícolas consumen el 95% de la producción química mundial de potasio, y aproximadamente el 90% de este potasio se suministra como KCl. Debido a su alto grado de reactividad, el potasio puro rara vez se usa en su forma elemental / metálica. Se utiliza como un poderoso agente reductor en química orgánica. Las aleaciones de potasio / sodio se utilizan como medio de intercambio de calor. El calor del potasio calienta el agua y la calienta lo suficiente como para hervir. Luego, el agua se convierte en vapor, que se utiliza para hacer funcionar los dispositivos que generan electricidad.
Bromo
En la industria se utiliza una amplia variedad de compuestos organobromados. Algunos se preparan a partir de bromo y otros se preparan a partir de bromuro de hidrógeno, que se obtiene quemando hidrógeno en bromo. Los retardantes de llama bromados representan un producto de creciente importancia y constituyen el mayor uso comercial del bromo. Uno de los principales usos del bromo es un purificador / desinfectante de agua, como alternativa al cloro. Los compuestos de bromo son pesticidas eficaces, que se utilizan como fumigantes del suelo en la agricultura, en particular en el cultivo de frutas, y como fumigantes para evitar que las plagas ataquen los cereales almacenados y otros productos.
Potasio y Bromo: comparación en la tabla
| Elemento | Potasio | Bromo |
| Densidad | 0,856 g / cm3 | 3,12 g / cm3 |
| Resistencia a la tracción | N / A | N / A |
| Límite de elastacidad | N / A | N / A |
| Módulo de Young | 3,53 GPa | N / A |
| Escala de Mohs | 0,4 | N / A |
| Dureza Brinell | 0,36 MPa | N / A |
| Dureza Vickers | N / A | N / A |
| Punto de fusion | 63,25 ° C | -7,3 ° C |
| Punto de ebullición | 760 ° C | 59 ° C |
| Conductividad térmica | 102,4 W / mK | 0,122 W / mK |
| Coeficiente de expansión térmica | 83 µm / mK | N / A |
| Calor especifico | 0,75 J / g K | 0,473 J / g K |
| Calor de fusión | 2,334 kJ / mol | 5,286 kJ / mol |
| Calor de vaporización | 79,87 kJ / mol | 15,438 kJ / mol |














