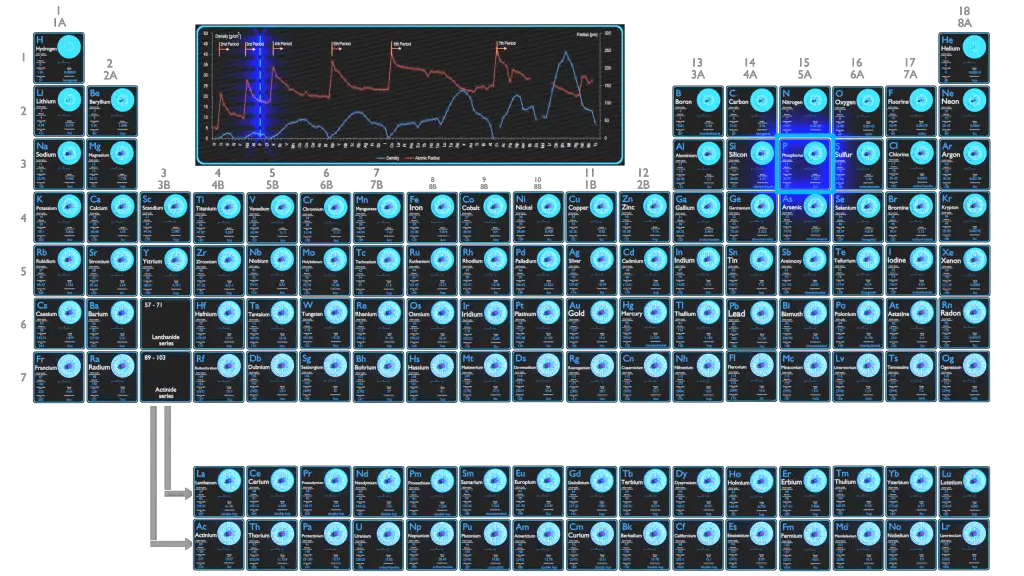
En tant qu’élément, le phosphore existe sous deux formes principales – le phosphore blanc et le phosphore rouge – mais comme il est hautement réactif, le phosphore ne se trouve jamais sous forme d’élément libre sur Terre. À 0,099 %, le phosphore est le pnictogène le plus abondant dans la croûte terrestre.
Sommaire
| Élément | Phosphore |
| Numéro atomique | 15 |
| Masse atomique [amu] | 30,9738 |
| Masse atomique [pm] | 107 |
| Densité à STP [g/cm3] | 1,823 |
| Nombre de protons | 15 |
| Nombre de neutrons (isotopes typiques) | 31 |
| Nombre d’électrons | 15 |
| Configuration électronique | [Ne] 3s2 3p3 |
| États d’oxydation | + 3,5/-3 |
| Affinité électronique [kJ/mol] | 72 |
| Electronégativité [échelle de Pauling] | 2,19 |
| Première énergie d’ionisation [eV] | 10,4867 |
Numéro atomique – Protons, électrons et neutrons dans le Phosphore
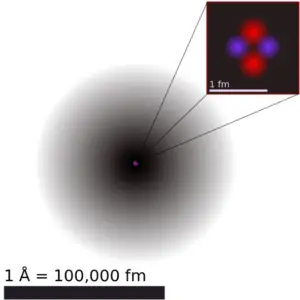
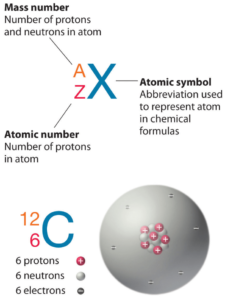 Le phosphore est un élément chimique de numéro atomique 15, ce qui signifie qu’il y a 15 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le phosphore est un élément chimique de numéro atomique 15, ce qui signifie qu’il y a 15 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A . La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Les nombres de masse des isotopes typiques du phosphore sont de 31.
Masse atomique du Phosphore
La masse atomique du phosphore est de 30,9738 u.
La masse atomique est la masse d’un atome. La masse atomique ou masse isotopique relative fait référence à la masse d’une seule particule et est donc liée à un certain isotope spécifique d’un élément. La masse atomique est portée par le noyau atomique, qui n’occupe qu’environ 10-12 du volume total de l’atome ou moins, mais il contient toute la charge positive et au moins 99,95 % de la masse totale de l’atome. Notez que chaque élément peut contenir plus d’ isotopes, donc cette masse atomique résultante est calculée à partir des isotopes naturels et de leur abondance.
Rayon atomique du Phosphore
Le rayon atomique de l’atome de phosphore est de 107 pm (rayon covalent).
Il faut noter que les atomes n’ont pas de frontière extérieure bien définie. Le rayon atomique d’un élément chimique est une mesure de la distance à laquelle le nuage d’électrons s’étend du noyau. Cependant, cela suppose que l’atome présente une forme sphérique, qui n’est respectée que pour les atomes dans le vide ou l’espace libre. Par conséquent, il existe diverses définitions non équivalentes du rayon atomique.
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre de phosphore est de 15. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique du phosphore est [Ne] 3s2 3p3.
Les états d’oxydation possibles sont +3,5/-3.
Densité de Phosphore
La densité du phosphore est de 1,823 g/cm3.
Les densités typiques de diverses substances sont à la pression atmosphérique.
La densité est définie comme la masse par unité de volume. C’est une propriété intensive, qui est mathématiquement définie comme la masse divisée par le volume:
ρ = m / V
Affinité électronique – Phosphore
L’affinité électronique du phosphore est de 72 kJ/mol.
En chimie et en physique atomique, l’ affinité électronique d’un atome ou d’une molécule est définie comme:
la variation d’énergie (en kJ/mole) d’un atome ou d’une molécule neutre (en phase gazeuse) lorsqu’un électron est ajouté à l’atome pour former un ion négatif.
X + e – → X – + énergie Affinité = – ∆H
En d’autres termes, il peut être exprimé comme la probabilité qu’a l’atome neutre de gagner un électron. Notez que les énergies d’ionisation mesurent la tendance d’un atome neutre à résister à la perte d’électrons. Les affinités électroniques sont plus difficiles à mesurer que les énergies d’ionisation.
Electronégativité du Phosphore
L’électronégativité du phosphore est de 2,19.
L’électronégativité, symbole χ, est une propriété chimique qui décrit la tendance d’un atome à attirer des électrons vers cet atome. A cet effet, une quantité sans dimension l’ échelle de Pauling, symbole χ, est la plus couramment utilisée.
L’électronégativité du Phosphore est : χ = 2,19
Première énergie d’ionisation du Phosphore
La première énergie d’ionisation du phosphore est de 10,4867 eV .
L’énergie d’ionisation, également appelée potentiel d’ionisation, est l’énergie nécessaire pour retirer un électron de l’atome neutre.
X + énergie → X + + e −
où X est n’importe quel atome ou molécule capable d’être ionisé, X+ est cet atome ou molécule avec un électron retiré (ion positif), et e– est l’électron retiré.
Un atome de phosphore, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus externe.
P + IE → P + + e – IE = 10,4867 eV
Source : www.luciteria.com