Cet article contient une comparaison des principales propriétés thermiques et atomiques du sodium et du potassium, deux éléments chimiques comparables du tableau périodique. Il contient également des descriptions de base et des applications des deux éléments. Sodium contre Potassium.
Sodium et Potassium – À propos des éléments


Source : www.luciteria.com
Sodium et Potassium – Applications
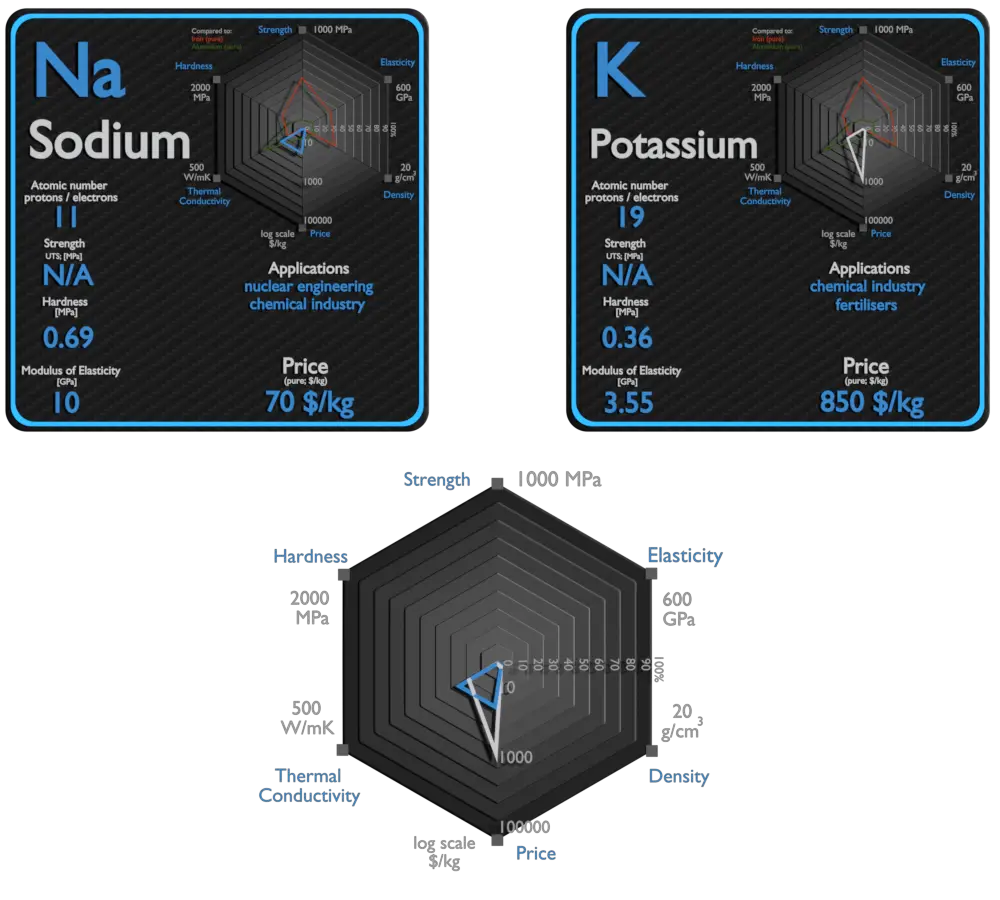
Sodium
Le sodium métallique est principalement utilisé pour la production de borohydrure de sodium, d’azoture de sodium, d’indigo et de triphénylphosphine. Une utilisation autrefois courante était la fabrication de tétraéthylplomb et de titane métallique; en raison de l’abandon du TEL et des nouvelles méthodes de production de titane. Un courant électrique et de la vapeur de sodium se combinent pour former une lueur jaunâtre. Ce principe est utilisé pour la fabrication des lampes à vapeur de sodium. Le sodium est parfois utilisé comme agent d’échange de chaleur dans les centrales nucléaires. Le sodium liquide est scellé dans des tuyaux entourant le cœur du réacteur. La chaleur générée est absorbée par le sodium et forcée à travers les tuyaux dans un échangeur de chaleur qui peut être utilisé pour générer de l’électricité.
Potassium
Le potassium (K) est un nutriment essentiel à la croissance des plantes. Il est classé comme macronutriment car les plantes absorbent de grandes quantités de K au cours de leur cycle de vie. Les engrais agricoles consomment 95 % de la production chimique mondiale de potassium, et environ 90 % de ce potassium est fourni sous forme de KCl. En raison de son haut degré de réactivité, le potassium pur est rarement utilisé sous sa forme élémentaire/métallique. Il est utilisé comme puissant agent réducteur en chimie organique. Les alliages Potassium/Sodium sont utilisés comme échangeur de chaleur. La chaleur du potassium réchauffe l’eau et la rend suffisamment chaude pour bouillir. Ensuite, l’eau est transformée en vapeur, qui est utilisée pour faire fonctionner des appareils qui génèrent de l’électricité.
Sodium et Potassium – Comparaison dans le tableau
| Élément | Sodium | Potassium |
| Densité | 0,968g/cm3 | 0,856g/cm3 |
| Résistance à la traction ultime | N / A | N / A |
| Limite d’élasticité | N / A | N / A |
| Module de Young | 10 GPa | 3,53 GPa |
| Échelle de Mohs | 0,4 | 0,4 |
| Dureté Brinell | 0,69 MPa | 0,36 MPa |
| Dureté Vickers | N / A | N / A |
| Point de fusion | 97,8°C | 63,25°C |
| Point d’ébullition | 883°C | 760°C |
| Conductivité thermique | 141W/mK | 102,4 W/mK |
| Coefficient de dilatation thermique | 71 µm/mK | 83 µm/mK |
| Chaleur spécifique | 1,23 J/g·K | 0,75 J/g·K |
| Température de fusion | 2,598 kJ/mol | 2,334 kJ/mole |
| Chaleur de vaporisation | 96,96 kJ/mole | 79,87 kJ/mole |