Este artículo contiene una comparación de las propiedades térmicas y atómicas clave del sodio y el potasio, dos elementos químicos comparables de la tabla periódica. También contiene descripciones básicas y aplicaciones de ambos elementos. Sodio vs Potasio.
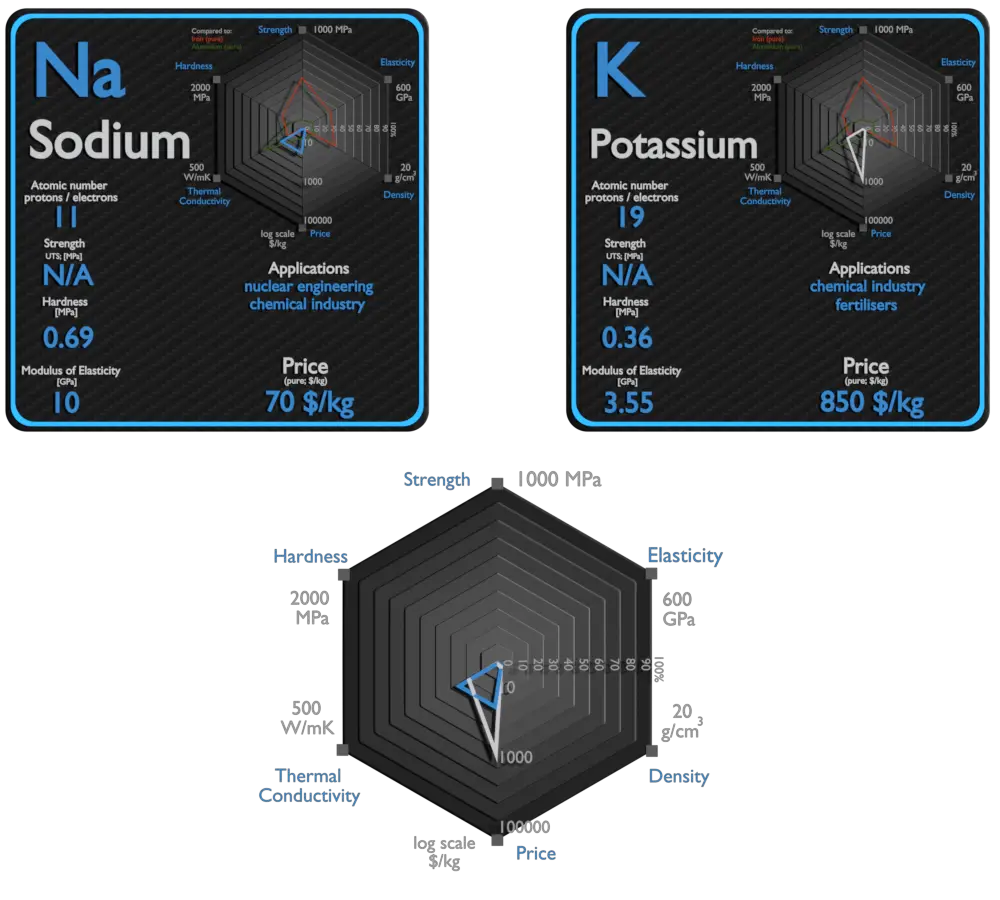
Sodio y Potasio: acerca de los elementos


Fuente: www.luciteria.com
Sodio y Potasio: aplicaciones
Sodio
El sodio metálico se utiliza principalmente para la producción de borohidruro de sodio, azida de sodio, índigo y trifenilfosfina. Un uso que alguna vez fue común fue la fabricación de plomo tetraetílico y metal de titanio; debido al alejamiento de TEL y los nuevos métodos de producción de titanio. Una corriente eléctrica y un vapor de sodio se combinan para formar un resplandor amarillento. Este principio se utiliza para la fabricación de lámparas de vapor de sodio. El sodio se utiliza ocasionalmente como medio de intercambio de calor en centrales nucleares. El sodio líquido se sella en las tuberías que rodean el núcleo del reactor. El calor generado es absorbido por el sodio y forzado a través de las tuberías en un intercambiador de calor que se puede utilizar para generar electricidad.
Potasio
El potasio (K) es un nutriente esencial para el crecimiento de las plantas. Se clasifica como macronutriente porque las plantas absorben grandes cantidades de K durante su ciclo de vida. Los fertilizantes agrícolas consumen el 95% de la producción química mundial de potasio, y aproximadamente el 90% de este potasio se suministra como KCl. Debido a su alto grado de reactividad, el potasio puro rara vez se usa en su forma elemental / metálica. Se utiliza como un poderoso agente reductor en química orgánica. Las aleaciones de potasio / sodio se utilizan como medio de intercambio de calor. El calor del potasio calienta el agua y la calienta lo suficiente como para hervir. Luego, el agua se convierte en vapor, que se utiliza para hacer funcionar los dispositivos que generan electricidad.
Sodio y Potasio: comparación en la tabla
| Elemento | Sodio | Potasio |
| Densidad | 0,968 g / cm3 | 0,856 g / cm3 |
| Resistencia a la tracción | N / A | N / A |
| Límite de elastacidad | N / A | N / A |
| Módulo de Young | 10 GPa | 3,53 GPa |
| Escala de Mohs | 0,4 | 0,4 |
| Dureza Brinell | 0,69 MPa | 0,36 MPa |
| Dureza Vickers | N / A | N / A |
| Punto de fusion | 97,8 ° C | 63,25 ° C |
| Punto de ebullición | 883 ° C | 760 ° C |
| Conductividad térmica | 141 W / mK | 102,4 W / mK |
| Coeficiente de expansión térmica | 71 µm / mK | 83 µm / mK |
| Calor especifico | 1,23 J / g K | 0,75 J / g K |
| Calor de fusión | 2,598 kJ / mol | 2,334 kJ / mol |
| Calor de vaporización | 96,96 kJ / mol | 79,87 kJ / mol |