Este artículo contiene una comparación de las propiedades térmicas y atómicas clave del nitrógeno y el fósforo, dos elementos químicos comparables de la tabla periódica. También contiene descripciones básicas y aplicaciones de ambos elementos. Nitrógeno vs Fósforo.
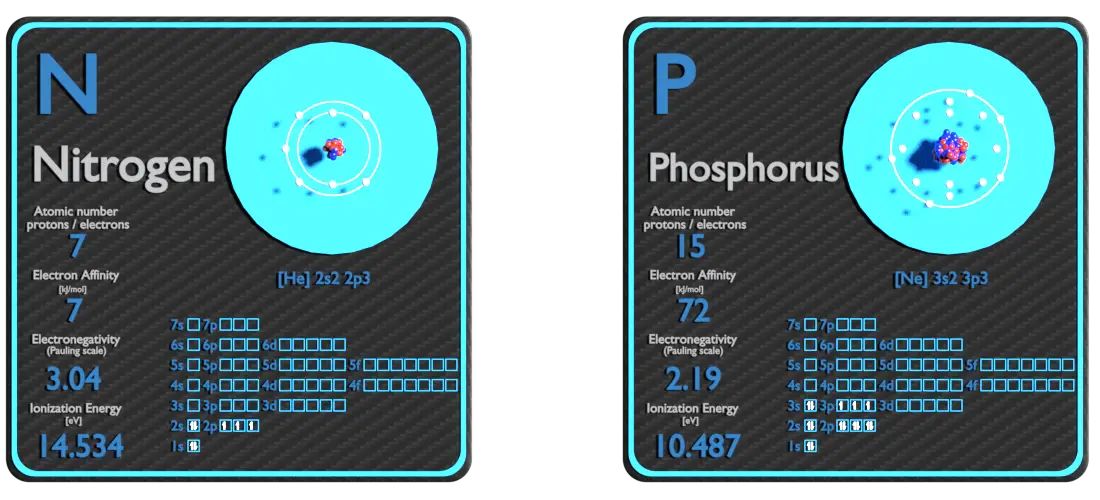
Nitrógeno y Fósforo: acerca de los elementos


Fuente: www.luciteria.com
Nitrógeno y Fósforo: aplicaciones
Nitrógeno
El nitrógeno en diversas formas químicas juega un papel importante en una gran cantidad de problemas ambientales. Las aplicaciones de los compuestos de nitrógeno son naturalmente muy variadas debido al enorme tamaño de esta clase: por lo tanto, aquí solo se considerarán las aplicaciones de nitrógeno puro. Dos tercios del nitrógeno producido por la industria se vende como gas y el tercio restante como líquido. En metalurgia, la nitruración es un proceso de cementación en el que la concentración de nitrógeno en la superficie de un ferroso aumenta por difusión desde el entorno circundante para crear una superficie cementada. La nitruración produce una superficie de producto dura y altamente resistente al desgaste (profundidades de caja poco profundas) con una buena capacidad de carga de contacto, buena resistencia a la fatiga por flexión y excelente resistencia al agarre. El amoníaco y los nitratos producidos sintéticamente son fertilizantes industriales clave, y los nitratos de los fertilizantes son contaminantes clave en la eutrofización de los sistemas de agua. Además de su uso en fertilizantes y reservas de energía, el nitrógeno es un componente de compuestos orgánicos tan diversos como el Kevlar utilizado en tejidos de alta resistencia y el cianoacrilato utilizado en superglue.
Fósforo
El fósforo es un nutriente vegetal esencial (el nutriente limitante con mayor frecuencia, después del nitrógeno), y la mayor parte de toda la producción de fósforo se encuentra en ácidos fosfóricos concentrados para fertilizantes agrícolas, que contienen entre un 70% y un 75% de P2O5. La gran mayoría de los compuestos de fósforo extraídos se consumen como fertilizantes. El fosfato es necesario para reemplazar el fósforo que las plantas eliminan del suelo, y su demanda anual está aumentando casi dos veces más rápido que el crecimiento de la población humana. Otras aplicaciones incluyen compuestos organofosforados en detergentes, pesticidas y agentes nerviosos.
Nitrógeno y Fósforo: comparación en la tabla
| Elemento | Nitrógeno | Fósforo |
| Densidad | 0,00125 g / cm3 | 1,823 g / cm3 |
| Resistencia a la tracción | N / A | N / A |
| Límite de elastacidad | N / A | N / A |
| Módulo de Young | N / A | N / A |
| Escala de Mohs | N / A | N / A |
| Dureza Brinell | N / A | N / A |
| Dureza Vickers | N / A | N / A |
| Punto de fusion | -209,9 ° C | 44,1 ° C |
| Punto de ebullición | -195,8 ° C | 280 ° C |
| Conductividad térmica | 0,02598 W / mK | 0,235 W / mK |
| Coeficiente de expansión térmica | N / A | N / A |
| Calor especifico | 1,04 J / g K | 0,77 J / g K |
| Calor de fusión | (N2) 0,7204 kJ / mol | 0,657 kJ / mol |
| Calor de vaporización | (N2) 5,56 kJ / mol | 51,9 kJ / mol |










