Cet article contient une comparaison des principales propriétés thermiques et atomiques de l’azote et du phosphore, deux éléments chimiques comparables du tableau périodique. Il contient également des descriptions de base et des applications des deux éléments. Azote vs Phosphore.
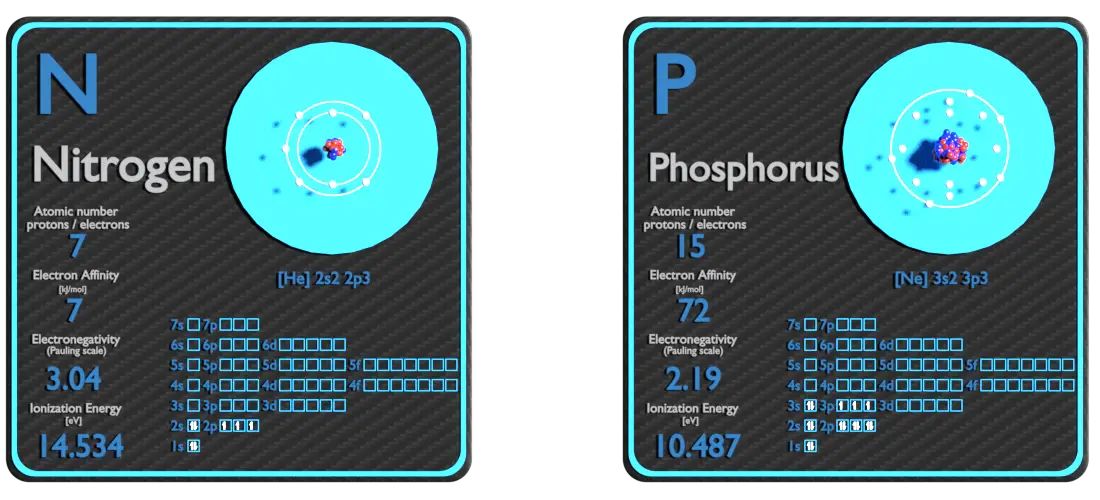
Azote et Phosphore – À propos des éléments


Source : www.luciteria.com
Azote et Phosphore – Applications
Azote
L’azote sous diverses formes chimiques joue un rôle majeur dans un grand nombre de problèmes environnementaux. Les applications des composés azotés sont naturellement extrêmement variées du fait de l’immensité de cette classe: ainsi, seules les applications de l’azote pur lui-même seront considérées ici. Les deux tiers de l’azote produit par l’industrie sont vendus sous forme de gaz et le tiers restant sous forme liquide. En métallurgie, la nitruration est un processus de cémentation dans lequel la concentration en azote de surface d’un ferreux est augmentée par diffusion à partir du milieu environnant pour créer une surface cémentée. La nitruration produit une surface de produit dure et très résistante à l’usure (profondeurs peu profondes) avec une bonne capacité de charge de contact, une bonne résistance à la fatigue par flexion et une excellente résistance au grippage. L’ammoniac et les nitrates produits synthétiquement sont les principaux engrais industriels, et les nitrates d’engrais sont des polluants clés dans l’eutrophisation des systèmes d’eau. Outre son utilisation dans les engrais et les réserves d’énergie, l’azote est un constituant de composés organiques aussi divers que le Kevlar utilisé dans les tissus à haute résistance et le cyanoacrylate utilisé dans la superglue.
Phosphore
Le phosphore est un nutriment essentiel pour les plantes (le nutriment le plus souvent limitant, après l’azote), et la majeure partie de toute la production de phosphore se fait dans des acides phosphoriques concentrés pour les engrais agricoles, contenant jusqu’à 70 % à 75 % de P2O5. La grande majorité des composés phosphorés extraits sont consommés comme engrais. Le phosphate est nécessaire pour remplacer le phosphore que les plantes retirent du sol, et sa demande annuelle augmente presque deux fois plus vite que la croissance de la population humaine. D’autres applications incluent les composés organophosphorés dans les détergents, les pesticides et les agents neurotoxiques.
Azote et Phosphore – Comparaison dans le tableau
| Élément | Azote | Phosphore |
| Densité | 0,00125g/cm3 | 1,823g/cm3 |
| Résistance à la traction ultime | N / A | N / A |
| Limite d’élasticité | N / A | N / A |
| Module de Young | N / A | N / A |
| Échelle de Mohs | N / A | N / A |
| Dureté Brinell | N / A | N / A |
| Dureté Vickers | N / A | N / A |
| Point de fusion | -209,9°C | 44,1°C |
| Point d’ébullition | -195,8°C | 280°C |
| Conductivité thermique | 0,02598 W/mK | 0,235 W/mK |
| Coefficient de dilatation thermique | N / A | N / A |
| Chaleur spécifique | 1,04 J/g·K | 0,77 J/g·K |
| Température de fusion | (N2) 0,7204 kJ/mole | 0,657 kJ/mole |
| Chaleur de vaporisation | (N2) 5,56 kJ/mole | 51,9 kJ/mole |










