Cet article contient une comparaison des principales propriétés thermiques et atomiques de l’hydrogène et du carbone, deux éléments chimiques comparables du tableau périodique. Il contient également des descriptions de base et des applications des deux éléments. Hydrogène vs Carbone.
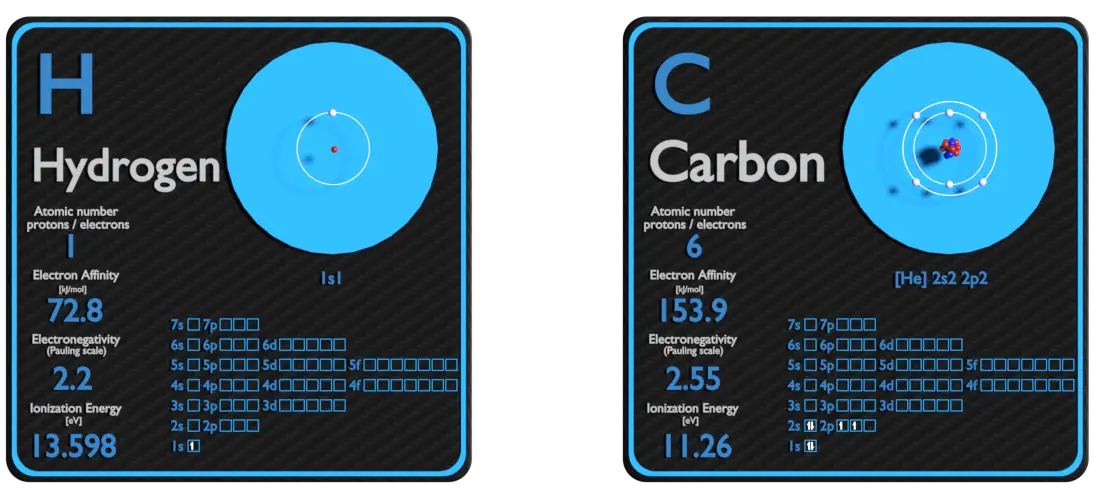
Hydrogène et Carbone – À propos des éléments


Source : www.luciteria.com
Hydrogène et Carbone – Applications
Hydrogène
L’hydrogène est polyvalent et peut être utilisé de différentes manières. Ces usages multiples peuvent être regroupés en deux grandes catégories. L’hydrogène comme matière première. Un rôle dont l’importance est reconnue depuis des décennies et qui continuera de croître et d’évoluer. La plus grande utilisation unique d’hydrogène dans le monde est la fabrication d’ammoniac, qui consomme environ les deux tiers de la production mondiale d’hydrogène. L’hydrogène est polyvalent et peut être utilisé de différentes manières. Ces usages multiples peuvent être regroupés en deux grandes catégories. L’hydrogène comme matière première pour d’autres procédés chimiques. Un rôle dont l’importance est reconnue depuis des décennies et qui continuera de croître et d’évoluer. Et l’hydrogène comme vecteur énergétique.
Carbone
La principale utilisation économique du carbone autre que la nourriture et le bois se présente sous la forme d’hydrocarbures, notamment le gaz méthane et le pétrole brut (pétrole). Le graphite et les diamants sont deux allotropes importants du carbone qui ont de nombreuses applications. Les utilisations du carbone et de ses composés sont extrêmement variées. Il peut former des alliages avec le fer, dont le plus courant est l’acier au carbone. Le carbone est un élément non métallique, qui est un élément d’alliage important dans tous les matériaux à base de métaux ferreux. Le carbone est toujours présent dans les alliages métalliques, c’est-à-dire dans toutes les nuances d’acier inoxydable et les alliages résistants à la chaleur. Le carbone est un austénitisant très puissant et augmente la résistance de l’acier. En fait, c’est le principal élément durcissant et il est essentiel à la formation de la cémentite, du Fe3C, de la perlite, de la sphéroïdite et de la martensite fer-carbone. L’ajout d’une petite quantité de carbone non métallique au fer échange sa grande ductilité contre une plus grande résistance. Le graphite est combiné avec des argiles pour former la «mine» utilisée dans les crayons utilisés pour écrire et dessiner. Il est également utilisé comme lubrifiant et pigment, comme matériau de moulage dans la fabrication du verre, dans les électrodes pour piles sèches et dans la galvanoplastie et l’électroformage, dans les balais des moteurs électriques et comme modérateur de neutrons dans les réacteurs nucléaires. Le charbon de bois a été utilisé depuis les temps les plus reculés pour un large éventail d’usages, y compris l’art et la médecine, mais son utilisation la plus importante a été de loin comme combustible métallurgique. Les fibres de carbone sont utilisées là où un faible poids, une rigidité élevée, une conductivité élevée ou lorsque l’apparence du tissage en fibre de carbone est souhaitée. Le graphite est combiné avec des argiles pour former la «mine» utilisée dans les crayons utilisés pour écrire et dessiner. Il est également utilisé comme lubrifiant et pigment, comme matériau de moulage dans la fabrication du verre, dans les électrodes pour piles sèches et dans la galvanoplastie et l’électroformage, dans les balais des moteurs électriques et comme modérateur de neutrons dans les réacteurs nucléaires. Le charbon de bois a été utilisé depuis les temps les plus reculés pour un large éventail d’usages, y compris l’art et la médecine, mais son utilisation la plus importante a été de loin comme combustible métallurgique. Les fibres de carbone sont utilisées là où un faible poids, une rigidité élevée, une conductivité élevée ou lorsque l’apparence du tissage en fibre de carbone est souhaitée. Le graphite est combiné avec des argiles pour former la «mine» utilisée dans les crayons utilisés pour écrire et dessiner. Il est également utilisé comme lubrifiant et pigment, comme matériau de moulage dans la fabrication du verre, dans les électrodes pour piles sèches et dans la galvanoplastie et l’électroformage, dans les balais des moteurs électriques et comme modérateur de neutrons dans les réacteurs nucléaires. Le charbon de bois a été utilisé depuis les temps les plus reculés pour un large éventail d’usages, y compris l’art et la médecine, mais son utilisation la plus importante a été de loin comme combustible métallurgique. Les fibres de carbone sont utilisées là où un faible poids, une rigidité élevée, une conductivité élevée ou lorsque l’apparence du tissage en fibre de carbone est souhaitée. dans les balais des moteurs électriques et comme modérateur de neutrons dans les réacteurs nucléaires. Le charbon de bois a été utilisé depuis les temps les plus reculés pour un large éventail d’usages, y compris l’art et la médecine, mais son utilisation la plus importante a été de loin comme combustible métallurgique. Les fibres de carbone sont utilisées là où un faible poids, une rigidité élevée, une conductivité élevée ou lorsque l’apparence du tissage en fibre de carbone est souhaitée. dans les balais des moteurs électriques et comme modérateur de neutrons dans les réacteurs nucléaires. Le charbon de bois a été utilisé depuis les temps les plus reculés pour un large éventail d’usages, y compris l’art et la médecine, mais son utilisation la plus importante a été de loin comme combustible métallurgique. Les fibres de carbone sont utilisées là où un faible poids, une rigidité élevée, une conductivité élevée ou lorsque l’apparence du tissage en fibre de carbone est souhaitée.
Hydrogène et Carbone – Comparaison dans le tableau
| Élément | Hydrogène | Carbone |
| Densité | 0,00009 g/cm3 | 2,26 g/cm3 |
| Résistance à la traction ultime | N / A | 15 MPa (graphite) ; 3500 MPa (fibre de carbone) |
| Limite d’élasticité | N / A | N / A |
| Module de Young | N / A | 4,1 GPa (graphite); 228 GPa (fibre de carbone) |
| Échelle de Mohs | N / A | 0,8 (graphite) |
| Dureté Brinell | N / A | N / A |
| Dureté Vickers | N / A | N / A |
| Point de fusion | -259,1 °C | 4099 °C |
| Point d’ébullition | -252,9 °C | 4527 °C |
| Conductivité thermique | 0,1805 W/mK | 129 W/mK |
| Coefficient de dilatation thermique | N / A | 0,8 µm/mK |
| Chaleur spécifique | 14.304 J/g·K | 0,71 J/g·K |
| Température de fusion | 0,05868 kJ/mol | N / A |
| Chaleur de vaporisation | 0,44936 kJ/mol | 355,8 kJ/mol |













