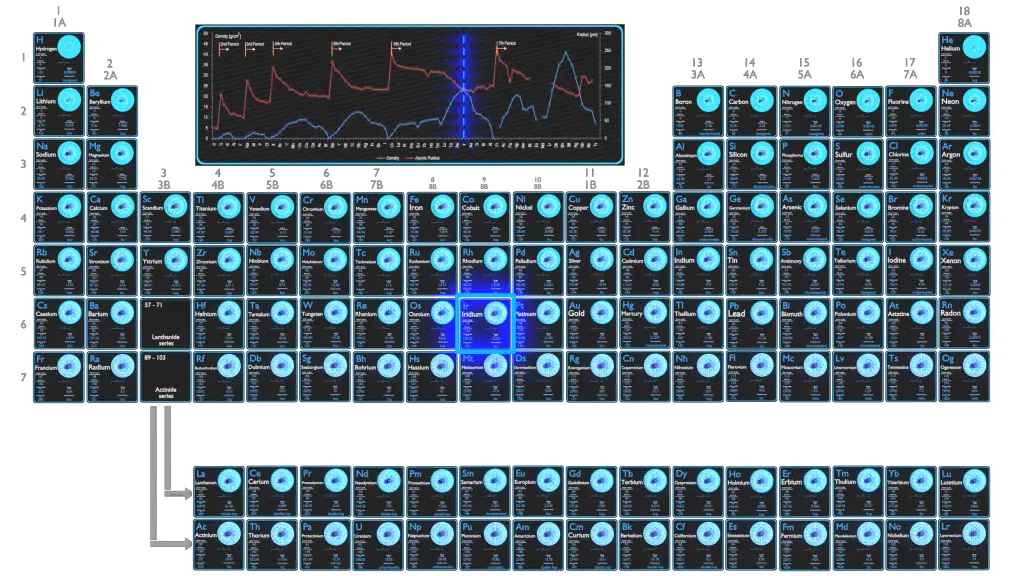
L’iridium est un métal de transition très dur, cassant, blanc argenté du groupe du platine, l’iridium est généralement crédité d’être le deuxième élément le plus dense (après l’osmium). C’est aussi le métal le plus résistant à la corrosion, même à des températures aussi élevées que 2000°C.
Sommaire
| Élément | Iridium |
| Numéro atomique | 77 |
| Masse atomique [amu] | 192,217 |
| Masse atomique [pm] | 141 |
| Densité à STP [g/cm3] | 22.65 |
| Nombre de protons | 77 |
| Nombre de neutrons (isotopes typiques) | 191,193 |
| Nombre d’électrons | 77 |
| Configuration électronique | [Xe] 4f14 5d7 6s2 |
| États d’oxydation | +3,4 |
| Affinité électronique [kJ/mol] | 151 |
| Electronégativité [échelle de Pauling] | 2,2 |
| Première énergie d’ionisation [eV] | 9,1 |
Numéro atomique – Protons, électrons et neutrons dans l’Iridium
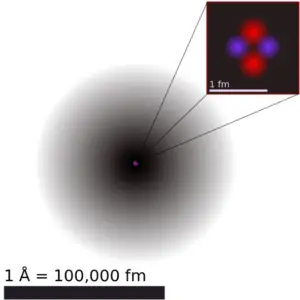
 L’iridium est un élément chimique de numéro atomique 77, ce qui signifie qu’il y a 77 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
L’iridium est un élément chimique de numéro atomique 77, ce qui signifie qu’il y a 77 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A . La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Les nombres de masse des isotopes typiques d’ Iridium sont 191, 193.
Masse atomique de l’Iridium
La masse atomique d’ Iridium est de 192,217 u.
La masse atomique est la masse d’un atome. La masse atomique ou la masse isotopique relative fait référence à la masse d’une seule particule et est donc liée à un certain isotope spécifique d’un élément. La masse atomique est portée par le noyau atomique, qui n’occupe qu’environ 10-12 du volume total de l’atome ou moins, mais il contient toute la charge positive et au moins 99,95 % de la masse totale de l’atome. Notez que chaque élément peut contenir plus d’ isotopes, donc cette masse atomique résultante est calculée à partir des isotopes naturels et de leur abondance.
Rayon atomique de l’Iridium
Le rayon atomique de l’ atome d’ Iridium est de 141 pm (rayon covalent).
Il faut noter que les atomes n’ont pas de frontière extérieure bien définie. Le rayon atomique d’un élément chimique est une mesure de la distance à laquelle le nuage d’électrons s’étend du noyau. Cependant, cela suppose que l’atome présente une forme sphérique, qui n’est respectée que pour les atomes dans le vide ou l’espace libre. Par conséquent, il existe diverses définitions non équivalentes du rayon atomique.
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre d’ Iridium est de 77. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres électrons négatifs (Z – 1) dans l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique d’ Iridium est [Xe] 4f14 5d7 6s2.
Les états d’oxydation possibles sont +3,4.
Densité d’Iridium
La densité d’ iridium est de 22,65 g/cm3.
Les densités typiques de diverses substances sont à la pression atmosphérique.
La densité est définie comme la masse par unité de volume. C’est une propriété intensive, qui est mathématiquement définie comme la masse divisée par le volume:
ρ = m / V
Affinité électronique – Iridium
L’affinité électronique d’ Iridium est de 151 kJ/mol.
En chimie et en physique atomique, l’ affinité électronique d’un atome ou d’une molécule est définie comme:
la variation d’énergie (en kJ/mole) d’un atome ou d’une molécule neutre (en phase gazeuse) lorsqu’un électron est ajouté à l’atome pour former un ion négatif .
X + e – → X – + énergie Affinité = – ∆H
En d’autres termes, il peut être exprimé comme la probabilité qu’a l’atome neutre de gagner un électron. Notez que les énergies d’ionisation mesurent la tendance d’un atome neutre à résister à la perte d’électrons. Les affinités électroniques sont plus difficiles à mesurer que les énergies d’ionisation.
Electronégativité d’Iridium
L’électronégativité d’ Iridium est de 2,2.
L’électronégativité, symbole χ, est une propriété chimique qui décrit la tendance d’un atome à attirer des électrons vers cet atome. A cet effet, une quantité sans dimension l’ échelle de Pauling, symbole χ, est la plus couramment utilisée.
L’électronégativité d’Iridium est: χ = 2,2
Première énergie d’ionisation de l’Iridium
La première énergie d’ionisation de l’iridium est de 9,1 eV.
L’énergie d’ionisation, également appelée potentiel d’ionisation, est l’énergie nécessaire pour retirer un électron de l’atome neutre.
X + énergie → X + + e −
où X est n’importe quel atome ou molécule capable d’être ionisé, X+ est cet atome ou molécule avec un électron retiré (ion positif), et e– est l’électron retiré.
Un atome d’iridium, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus externe.
Ir + IE → Ir + + e – IE = 9,1 eV
Source : www.luciteria.com