Cet article contient une comparaison des principales propriétés thermiques et atomiques du potassium et du zinc, deux éléments chimiques comparables du tableau périodique. Il contient également des descriptions de base et des applications des deux éléments. Potassium contre Zinc.
[votre_espaceur]
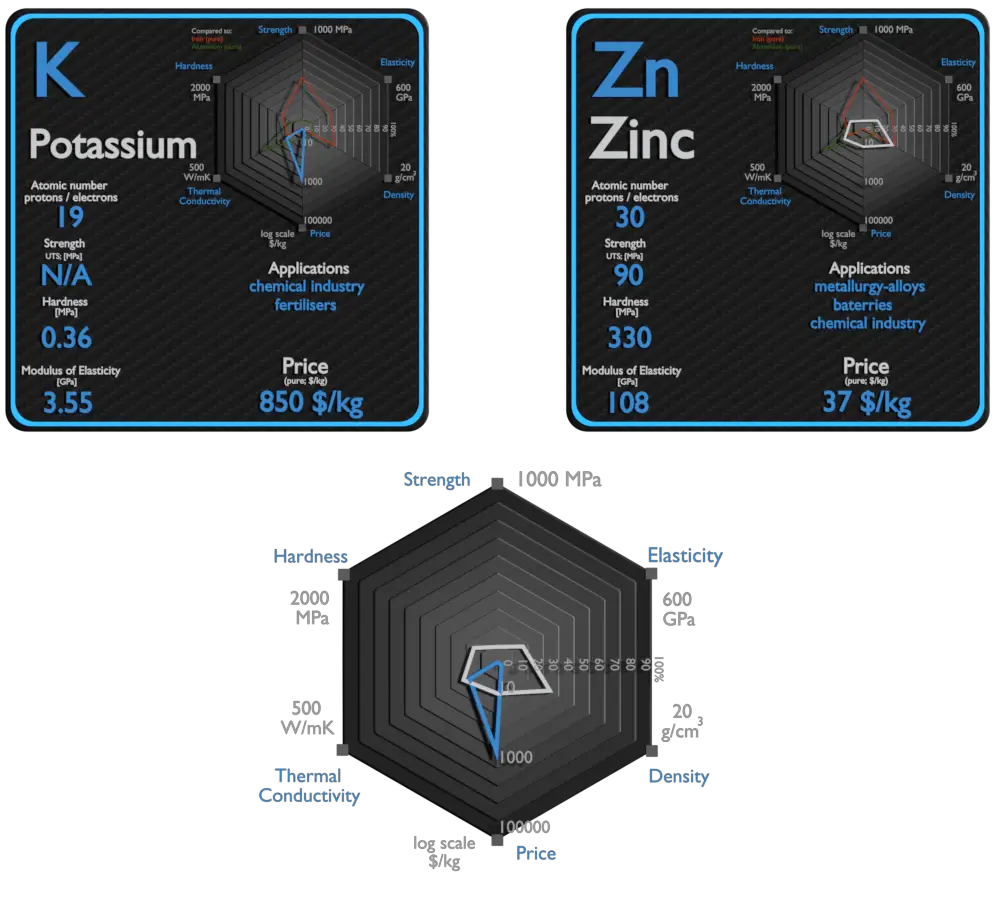
Potassium et Zinc – À propos des éléments
Potassium
Le potassium a d’abord été isolé de la potasse, les cendres des plantes, d’où son nom dérive. Dans le tableau périodique, le potassium fait partie des métaux alcalins. Tous les métaux alcalins ont un seul électron de valence dans la couche électronique externe, qui est facilement éliminé pour créer un ion avec une charge positive – un cation, qui se combine avec des anions pour former des sels. Le potassium naturel est composé de trois isotopes, dont 40K est radioactif. Des traces de 40K se trouvent dans tout le potassium, et c’est le radio-isotope le plus courant dans le corps humain.
Zinc
À certains égards, le zinc est chimiquement similaire au magnésium : les deux éléments ne présentent qu’un seul état d’oxydation normal (+2) et les ions Zn2+ et Mg2+ sont de taille similaire.


Source : www.luciteria.com
[votre_espaceur]
Potassium et Zinc – Applications
Potassium
Le potassium (K) est un nutriment essentiel à la croissance des plantes. Il est classé comme macronutriment car les plantes absorbent de grandes quantités de K au cours de leur cycle de vie. Les engrais agricoles consomment 95 % de la production chimique mondiale de potassium, et environ 90 % de ce potassium est fourni sous forme de KCl. En raison de son haut degré de réactivité, le potassium pur est rarement utilisé sous sa forme élémentaire/métallique. Il est utilisé comme puissant agent réducteur en chimie organique. Les alliages Potassium/Sodium sont utilisés comme échangeur de chaleur. La chaleur du potassium réchauffe l’eau et la rend suffisamment chaude pour bouillir. Ensuite, l’eau est transformée en vapeur, qui est utilisée pour faire fonctionner des appareils qui génèrent de l’électricité.
[/votre_panneau]
[/votre_ombre]
Zinc
Le zingage résistant à la corrosion du fer (galvanisation à chaud) est la principale application du zinc. Le revêtement de l’acier constitue la plus grande utilisation unique du zinc, mais il est utilisé en gros tonnages dans les pièces moulées en alliage de zinc, sous forme de poussière et d’oxyde de zinc, et dans les produits en zinc corroyé. L’acier galvanisé est simplement de l’acier au carbone recouvert d’une fine couche de zinc. Le zinc protège le fer en se corrodant d’abord, mais le zinc se corrode beaucoup moins vite que l’acier. D’autres applications concernent les batteries électriques, les petites pièces moulées non structurelles et les alliages tels que le laiton. Une variété de composés de zinc sont couramment utilisés, tels que le carbonate de zinc et le gluconate de zinc (comme compléments alimentaires), le chlorure de zinc (dans les déodorants), la pyrithione de zinc (shampoings antipelliculaires), le sulfure de zinc (dans les peintures luminescentes) et le diméthylzinc ou le diéthylzinc. au laboratoire biologique. Le recyclage est un élément clé du monde des matériaux modernes dans lequel se trouve le zinc. Le zinc, comme tous les métaux (et contrairement aux matériaux synthétiques) peut être recyclé indéfiniment sans dégradation.
[/votre_panneau]
[/votre_ombre]
Potassium et Zinc – Comparaison dans le tableau
| Élément | Potassium | Zinc |
| Densité | 0,856g/cm3 | 7,14 g/cm3 |
| Résistance à la traction ultime | N / A | 90 MPa |
| Limite d’élasticité | N / A | 75 MPa |
| Module de Young | 3,53 GPa | 108 GPa |
| Échelle de Mohs | 0,4 | 2,5 |
| Dureté Brinell | 0,36 MPa | 330 MPa |
| Dureté Vickers | N / A | N / A |
| Point de fusion | 63,25°C | 419,53°C |
| Point d’ébullition | 760°C | 907 °C |
| Conductivité thermique | 102,4 W/mK | 116W/mK |
| Coefficient de dilatation thermique | 83 µm/mK | 30,2 µm/mK |
| Chaleur spécifique | 0,75 J/g·K | 0,39 J/g·K |
| Température de fusion | 2 334 kJ / mol | 7 322 kJ / mol |
| Chaleur de vaporisation | 79,87 kJ / mol | 115,3 kJ / mol |


















