Concentrações significativas de boro ocorrem na Terra em compostos conhecidos como minerais de borato. Existem mais de 100 minerais de borato diferentes, mas os mais comuns são: bórax, quernita, ulexita etc. O boro natural consiste principalmente em dois isótopos estáveis, 11B (80,1%) e 10B (19,9%). Na indústria nuclear, o boro é comumente usado como absorvedor de nêutrons devido à alta seção transversal de nêutrons do isótopo 10B. Sua seção de choque de reação (n,alfa) para nêutrons térmicos é de cerca de 3840 barns (para nêutrons de 0,025 eV). O isótopo 11B tem seção transversal de absorção para nêutrons térmicos de cerca de 0,005 barns (para nêutrons de 0,025 eV). A maioria das reações (n,alfa) de nêutrons térmicos são reações 10B(n,alfa)7Li acompanhadas por emissão gama de 0,48 MeV.
Resumo
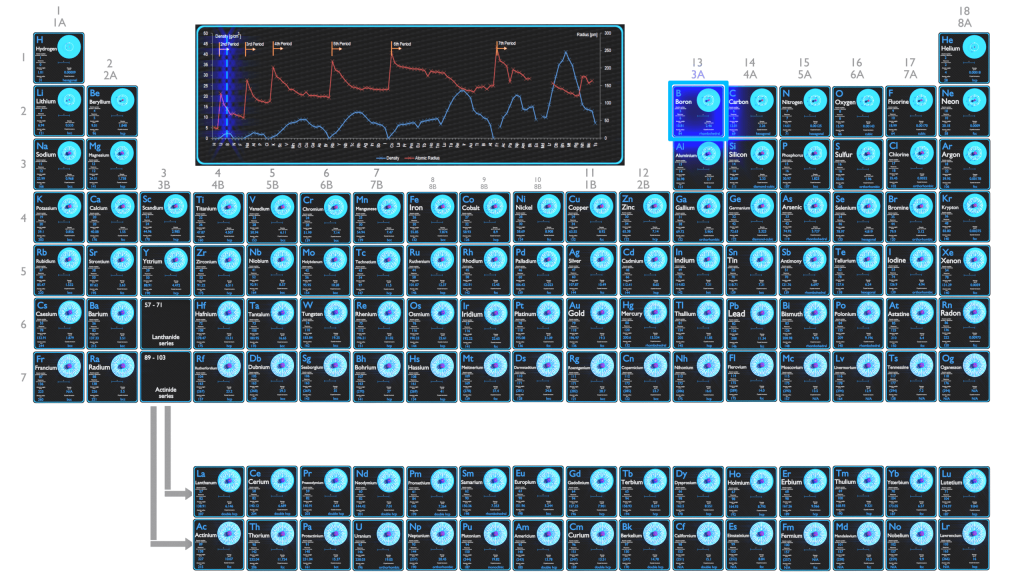
| Elemento | Boro |
| Número atômico | 5 |
| Massa atômica [amu] | 10,811 |
| Massa atômica [pm] | 84 |
| Densidade em STP [g/cm3] | 2,46 |
| Número de prótons | 5 |
| Número de nêutrons (isótopos típicos) | 10; 11 |
| Número de elétrons | 5 |
| Configuração eletrônica | [Ele] 2s2 2p1 |
| Estados de oxidação | -5; -1; +1; +2; +3 |
| Afinidade eletrônica [kJ/mol] | 26,7 |
| Eletronegatividade [escala de Pauling] | 2,04 |
| Primeira energia de ionização [eV] | 8,298 |
Número atômico – prótons, elétrons e nêutrons em Boro
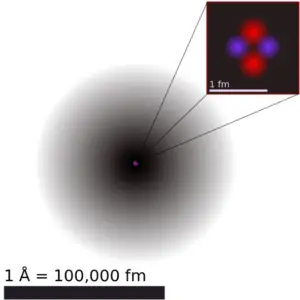
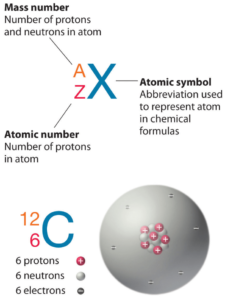 O boro é um elemento químico com número atômico 5, o que significa que há 5 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O boro é um elemento químico com número atômico 5, o que significa que há 5 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecido como excesso de nêutrons: D = N – Z = A – 2Z.
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que têm o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Os números de massa de isótopos típicos de Boro são 10; 11.
Massa Atômica do Boro
A massa atômica do boro é 10,811 u.
A massa atômica é a massa de um átomo. A massa atômica ou massa isotópica relativa refere-se à massa de uma única partícula e, portanto, está ligada a um certo isótopo específico de um elemento. A massa atômica é transportada pelo núcleo atômico, que ocupa apenas cerca de 10-12 do volume total do átomo ou menos, mas contém toda a carga positiva e pelo menos 99,95% da massa total do átomo. Observe que cada elemento pode conter mais isótopos, portanto, essa massa atômica resultante é calculada a partir de isótopos de ocorrência natural e sua abundância.
Raio Atômico do Boro
O raio atômico do átomo de boro é 84pm (raio covalente).
Deve-se notar que os átomos não possuem um limite externo bem definido. O raio atômico de um elemento químico é uma medida da distância até a qual a nuvem de elétrons se estende do núcleo. No entanto, isso pressupõe que o átomo apresente uma forma esférica, que só é obedecida para átomos no vácuo ou no espaço livre. Portanto, existem várias definições não equivalentes de raio atômico.
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro de Boro é 5. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os demais (Z – 1) elétrons negativos no átomo.
Uma vez que o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas eletrônicas de cada elemento, particularmente a camada de valência mais externa, é o principal fator para determinar seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Boro é [He] 2s2 2p1.
Os estados de oxidação possíveis são -5; -1; +1; +2; +3.
Densidade de Boro
A densidade do Boro é 2,46 g/cm3.
As densidades típicas de várias substâncias estão à pressão atmosférica.
A densidade é definida como a massa por unidade de volume. É uma propriedade intensiva, que é matematicamente definida como massa dividida pelo volume:
ρ = m/V
Afinidade Eletrônica – Boro
A afinidade eletrônica do Boro é de 26,7 kJ/mol.
Em química e física atômica, a afinidade eletrônica de um átomo ou molécula é definida como:
a mudança na energia (em kJ/mol) de um átomo ou molécula neutra (na fase gasosa) quando um elétron é adicionado ao átomo para formar um íon negativo.
X + e – → X – + energia Afinidade = – ∆H
Em outras palavras, pode ser expresso como a probabilidade do átomo neutro ganhar um elétron. Observe que as energias de ionização medem a tendência de um átomo neutro de resistir à perda de elétrons. As afinidades eletrônicas são mais difíceis de medir do que as energias de ionização.
Eletronegatividade do Boro
A eletronegatividade do boro é 2,04.
A eletronegatividade, símbolo χ, é uma propriedade química que descreve a tendência de um átomo de atrair elétrons para este átomo. Para isso, uma grandeza adimensional da escala de Pauling, símbolo χ, é a mais utilizada.
A eletronegatividade do Boro é: χ = 2,04
Primeira Energia de Ionização do Boro
A primeira energia de ionização do boro é 8,298 eV.
A energia de ionização, também chamada de potencial de ionização, é a energia necessária para remover um elétron do átomo neutro.
X + energia → X + + e −
onde X é qualquer átomo ou molécula capaz de ser ionizado, X+ é aquele átomo ou molécula com um elétron removido (íon positivo) e e− é o elétron removido.
Um átomo de boro, por exemplo, requer a seguinte energia de ionização para remover o elétron mais externo.
B + IE → B + + e − IE = 8,298 eV
Fonte: www.luciteria.com