Este artigo contém uma comparação das principais propriedades térmicas e atômicas do lítio e do sódio, dois elementos químicos comparáveis da tabela periódica. Ele também contém descrições básicas e aplicações de ambos os elementos. Lítio vs. Sódio.
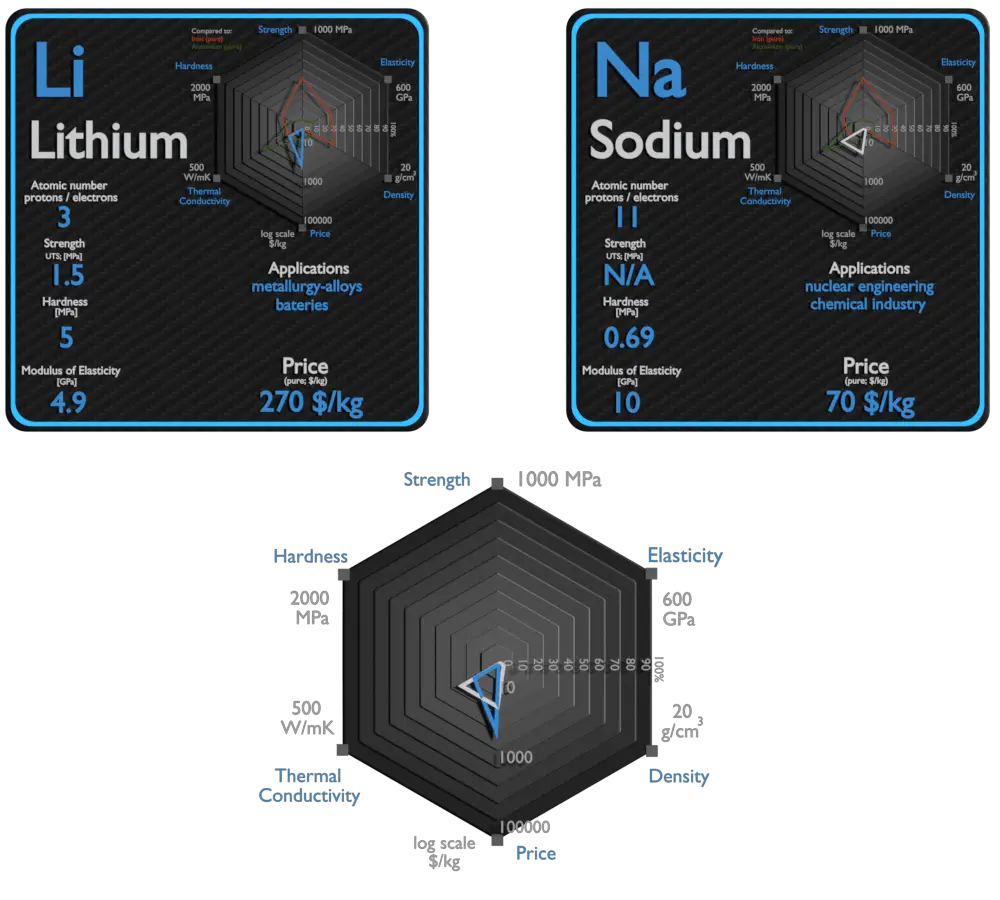
Lítio e Sódio – Sobre Elementos


Fonte: www.luciteria.com
Lítio e Sódio – Aplicações
Lítio
O lítio tem muitas aplicações, desde graxa lubrificante, adições de ligas em particular para ligas de alumínio e magnésio, até esmaltes para cerâmica e, finalmente, baterias de lítio. Em particular, o lítio é e continuará a desempenhar um papel cada vez mais importante no futuro do ar limpo movido a bateria. As baterias de lítio são amplamente utilizadas em dispositivos eletrônicos de consumo portáteis e em veículos elétricos, desde veículos de tamanho normal até brinquedos controlados por rádio. O termo “bateria de lítio” refere-se a uma família de diferentes composições químicas de lítio-metal, compreendendo muitos tipos de cátodos e eletrólitos, mas todos com lítio metálico como ânodo.
Sódio
O sódio metálico é usado principalmente para a produção de borohidreto de sódio, azida de sódio, índigo e trifenilfosfina. Um uso comum era a fabricação de chumbo tetraetila e titânio metálico; por causa do afastamento do TEL e dos novos métodos de produção de titânio. Uma corrente elétrica e vapor de sódio se combinam para formar um brilho amarelado. Este princípio é usado para a fabricação de lâmpadas de vapor de sódio. O sódio é ocasionalmente usado como meio de troca de calor em usinas nucleares. O sódio líquido é selado em tubos ao redor do núcleo do reator. O calor gerado é absorvido pelo sódio e forçado através dos tubos em um trocador de calor que pode ser usado para gerar eletricidade.
Lítio e Sódio – Comparação na Tabela
| Elemento | Lítio | Sódio |
| Densidade | 0,535 g/cm3 | 0,968 g/cm3 |
| Resistência à tração | 1,5 MPa | N/D |
| Força de Rendimento | N/D | N/D |
| Módulo de elasticidade de Young | 4,9 GPa | 10 GPa |
| Escala de Mohs | 0,6 | 0,4 |
| Dureza Brinell | 5 MPa | 0,69 MPa |
| Dureza Vickers | N/D | N/D |
| Ponto de fusão | 180,5 °C | 97,8 °C |
| Ponto de ebulição | 1342 °C | 883 °C |
| Condutividade térmica | 85 W/mK | 141 W/mK |
| Coeficiente de Expansão Térmica | 46 µm/mK | 71 µm/mK |
| Calor específico | 3,6 J/gK | 1,23 J/gK |
| Calor de fusão | 3 kJ/mol | 2,59 kJ/mol |
| Calor da vaporização | 145,92 kJ/mol | 96,96 kJ/mol |













