Este artículo contiene una comparación de las propiedades térmicas y atómicas clave del litio y el azufre, dos elementos químicos comparables de la tabla periódica. También contiene descripciones básicas y aplicaciones de ambos elementos. Litio vs Azufre.
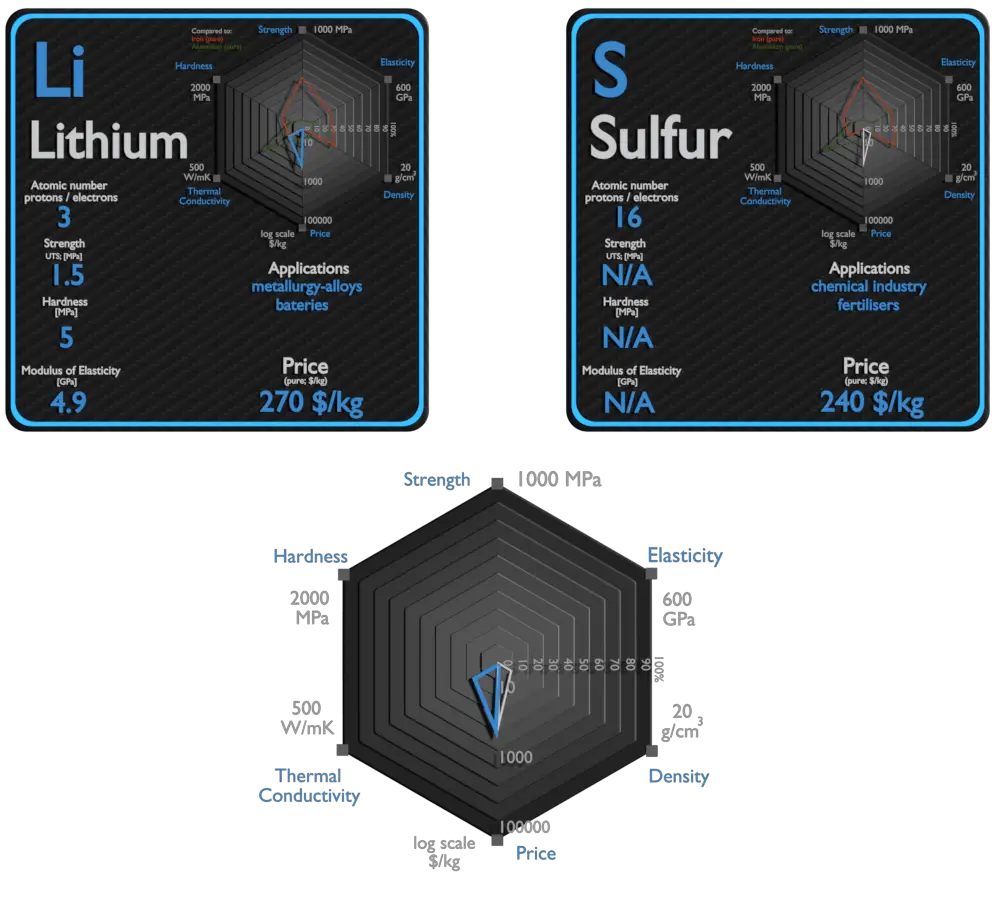
Litio y Azufre: acerca de los elementos


Fuente: www.luciteria.com
Litio y Azufre – Aplicaciones
Litio
El litio tiene muchas aplicaciones, desde grasas lubricantes, adiciones de aleación, en particular para aleaciones de aluminio y magnesio, hasta esmaltes para cerámica y, finalmente, baterías de litio. En particular, el litio es y seguirá desempeñando un papel cada vez más importante en el futuro del aire limpio alimentado por baterías. Las baterías de litio se utilizan ampliamente en dispositivos electrónicos portátiles de consumo y en vehículos eléctricos que van desde vehículos de tamaño completo hasta juguetes controlados por radio. El término «batería de litio» se refiere a una familia de diferentes químicas de litio-metal, que comprende muchos tipos de cátodos y electrolitos, pero todos con litio metálico como ánodo.
Azufre
El mayor uso comercial del elemento es la producción de ácido sulfúrico para fertilizantes de sulfato y fosfato y otros procesos químicos. El azufre se utiliza cada vez más como componente de fertilizantes. La forma más importante de azufre para fertilizantes es el mineral sulfato de calcio. El elemento azufre se utiliza en fósforos, insecticidas y fungicidas. Muchos compuestos de azufre son olorosos, y los olores del gas natural aromatizado, el aroma de la mofeta, la toronja y el ajo se deben a compuestos orgánicos de azufre.
Litio y Azufre: comparación en la tabla
| Elemento | Litio | Azufre |
| Densidad | 0,535 g/cm3 | 1,96 g/cm3 |
| Resistencia a la tracción | 1,5 MPa | N / A |
| Límite de elastacidad | N / A | N / A |
| Módulo de Young | 4,9 GPa | N / A |
| Escala de Mohs | 0,6 | 2 |
| Dureza Brinell | 5 MPa | N / A |
| Dureza Vickers | N / A | N / A |
| Punto de fusion | 180,5 °C | 112,8 °C |
| Punto de ebullición | 1342 °C | 444,7 °C |
| Conductividad térmica | 85 W/mK | 0,269 W/mK |
| Coeficiente de expansión térmica | 46 µm/mK | N / A |
| Calor especifico | 3,6 J/g K | 0,71 J/g K |
| Calor de fusión | 3 kJ/mol | 1,7175 kJ/mol |
| Calor de vaporización | 145,92 kJ/mol | 45 kJ/mol |













