El arsénico se encuentra en muchos minerales, generalmente en combinación con azufre y metales, pero también como un cristal elemental puro. El arsénico es un metaloide.
Protones y neutrones en Arsénico
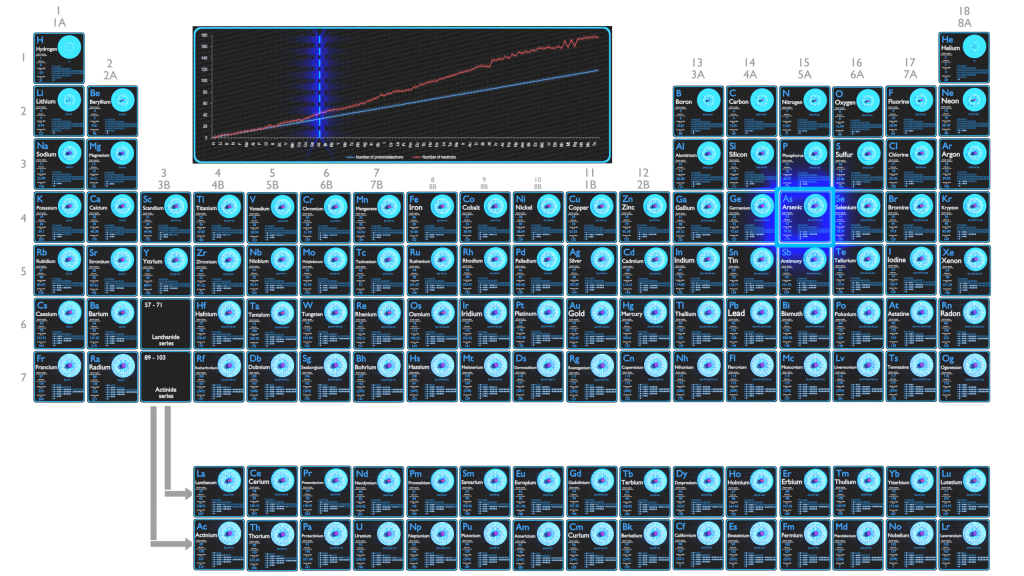
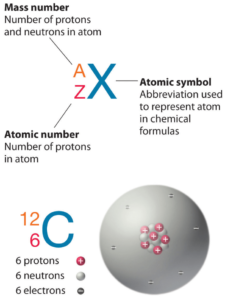 El arsénico es un elemento químico con número atómico 33, lo que significa que hay 33 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El arsénico es un elemento químico con número atómico 33, lo que significa que hay 33 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El número total de neutrones en el núcleo de un átomo se llama el número de neutrones del átomo y se le da el símbolo N . Número de neutrones más el número atómico es igual al número de masa atómica: N + Z = A . La diferencia entre el número de neutrones y el número atómico se conoce como exceso de neutrones : D = N – Z = A – 2Z.
Para los elementos estables, suele haber una variedad de isótopos estables. Los isótopos son nucleidos que tienen el mismo número atómico y, por lo tanto, son el mismo elemento, pero difieren en el número de neutrones. El número de masas de isótopos típicos de arsénico es 75.
Principales isótopos del Arsénico
El arsénico se encuentra solo en un isótopo natural: 75As.
El arsénico-75 está compuesto por 33 protones, 42 neutrones y 33 electrones.
Isótopos que ocurren naturalmente
| Isótopo | Abundancia | Número de neutrones |
| 75As | 100% | 42 |
Isótopos inestables típicos
| Isótopo | Media vida | Modo de decaimiento | Producto |
| 73As | 80,3 d | captura de electrones | 73Ge |
| 74As | 17,8 d | captura de electrones | 74Ge |
Electrones y configuración electrónica
El número de electrones en un átomo eléctricamente neutro es el mismo que el número de protones en el núcleo. Por lo tanto, el número de electrones en el átomo neutro de Arsénico es 33. Cada electrón está influenciado por los campos eléctricos producidos por la carga nuclear positiva y los otros electrones negativos (Z – 1) en el átomo.
Dado que el número de electrones y su disposición son responsables del comportamiento químico de los átomos, el número atómico identifica los diversos elementos químicos. La configuración de estos electrones se deriva de los principios de la mecánica cuántica. El número de electrones en las capas de electrones de cada elemento, particularmente la capa de valencia más externa, es el factor principal para determinar su comportamiento de enlace químico. En la tabla periódica, los elementos se enumeran en orden de número atómico creciente Z.
La configuración electrónica del arsénico es [Ar] 3d10 4s2 4p3 .
Los posibles estados de oxidación son + 3,5 / -3 .
Aplicación más común de Arsénico
La forma elemental de arsénico se usa comúnmente en aleaciones para baterías de plomo-ácido y cubiertas de cables . Los compuestos de arsénico también se utilizan en semiconductores y diodos emisores de luz . El arsénico se utiliza como agente dopante en semiconductores (arseniuro de galio) para dispositivos de estado sólido. También se utiliza en bronceado, pirotecnia y endurecimiento de perdigones .
Resumen
| Elemento | Arsénico |
| Numero de protones | 33 |
| Número de neutrones (isótopos típicos) | 75 |
| Numero de electrones | 33 |
| Configuración electronica | [Ar] 3d10 4s2 4p3 |
| Estados de oxidación | + 3,5 / -3 |
Fuente: www.luciteria.com